
Dizolvanti aposi
In cazul in care una din perechile acid-baza conjugate, ce constituie un sistem de tipul reprezentat in ecuatia
![]() Acid
1 + Baza 2 . Baza 1 + Acid 2,
Acid
1 + Baza 2 . Baza 1 + Acid 2,
apare in proportie mult mai mare decat cealalta pereche acid-baza poate fi considerat solvent.
O substanta care se comporta fata de acizi ca o baza si fata de baze ca acid este numita amfotera sau amfiprotica.cat cealalta pereche acid-baza cealalta pereche acid-baza pul reprezentat in ecuatia Acid 1 +
Unul dintre dizolvantii cei mai utilizati este apa. De aceea vom examina intai echilibrul protolitic al unui acid AH, in solutie apoasa:
![]() AH + H2O A- + H3O+
AH + H2O A- + H3O+
Aplicand legea maselor se obtine:
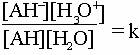
Cum solutia este diluata, adica A-], [AH], [H3O+] au valori foarte mici, concentratia apei de la numitorul ecuatiei este 1 este constanta (cca. 55,5 moli/l ). De aceea ea se include in constanta de echilibru, obtinandu-se:
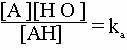
Marimea ka este constanta de aciditate a acidului AH si reprezinta o masura a tariei acidului AH, in solutie apoasa.
Aplicand legea maselor ecuatiei
![]() H2O + H2O H3O+ + HO- se obtine constanta de aciditate a apei:
H2O + H2O H3O+ + HO- se obtine constanta de aciditate a apei:
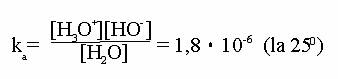
Dupa
cum se vede, apa este un acid foarte slab. Incluzand, din acelasi motiv ca
mai sus, concentratia H2O] in constanta, se obtine constanta
de autoprotoliza![]() sau produsul ionic al
apei:
sau produsul ionic al
apei:
kω= [H3O+][HO-]= kω x55,5= 1,0x10-14 (la 250 )
Aplicand legea maselor la reactia de protoliza a unei baze, de exemplu:
NH3+H2O = NH4+ + HO-
Se obtine constanta de bazicitate :
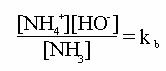
Constanta kb este o masura a tariei unei baze, in acelasi mod ca marimea ka, in cazul unui acid.
Unitatile uzuale ale constantelor de echilibru protolitic sunt moli/l.
Cele trei constante de echilibru, mentionate mai sus, sunt legate prin relatia:
ka · kb = kω
in care ka si kb se refera la perechea acid-baza conjugata.
Protonul se deosebeste de toti ceilalti ioni (cu exceptia particulelor α, He2+) prin aceea ca este un simplu nucleu, fara invelis de electroni. Raza sa este de aproximativ 10-13 cm, cu mult mai mica decat razele celorlalti ioni, care sunt de ordinul 10-8 cm. Din cauza micimii lui, care determina un camp foarte intens in jurul sau, protonul nu poate exista liber, ci se combina cu orice pereche de electroni neparticipanti ai atomilor, moleculelor sau ionilor care poseda asemenea electroni.
In solutie apoasa, protonul nu poate exista decat legat de o molecula de apa, sub forma de ion hidroniu ( numit si ion de oxoniu sau de hidroxoniu ):
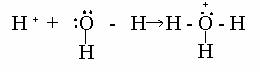
Din motive de ordin practic, concentratia ionilor de hidroniu, in solutie apoasa, se exprima sub forma exponentului de activitate, definit prin expresia:
pH = - log H3O+
In mod similar, constantele de aciditate si de bazicitate se pot exprima sub forma de exponenti de aciditate si exponenti de bazicitate:
pka = - log ka; pkb = - log kb
Pentru un acid cu ka = 10-5 exponentul de aciditate este pka = 5.
Cu cat acidul este mai tare, valoarea numerica a pka este mai mica.
Introducand valoarea lui kω in ecuatia
ka · kb = kω si logaritmand se obtine :
pka = 14 - pkb
Cu ajutorul acestei ecuatii este posibil sa se exprime aciditatea sau bazicitatea unei substante intr-o scara unica. Unui acid tare ii corespunde o baza conjugata slaba si invers.
Constante si exponenti de aciditate (in solutie apoasa)
|
Acid |
Baza conjugata |
ka |
kb |
|
HOOC-COOH |
HOOC-COO- |
5,7x10-2 |
1,2 |
|
HCOOH |
HCOO- |
2,1x10-4 |
3,7 |
|
HOOC-COO- |
OOC-COO- |
6,8x10-5 |
4,2 |
|
CH3COOH |
CH3COO- |
1,8x10-5 |
4,75 |
|
NH4+ |
NH3 |
3,3x10-10 |
9,5 |
|
CH3 NH3+ |
CH3NH2 |
1,6x10-11 |
10,8 |
|
(CH3)2NH2+ |
(CH3)2NH |
1,2x10-11 |
10,9 |
|
(CH3)3NH+ |
(CH3)3N |
1,2x10-11 |
10,9 |
Dizolvanti neaposi
In solutie apoasa, echilibrele protolitice sunt limitate de constate de autoprotoliza a apei, intre doua valori extreme, anume intre pH = 0 si 14. La pH = 0, concentratia ionilor de H3O+ este 1 mol/l si a ionilor de HO- este 10-14 moli/litru, la pH = 14, concentratia ionilor de H3O+ este de 10-14 moli/l, iar la HO- este 1 mol/l.
Se cunosc si se utilizeaza si alti dizolvanti, numiti amfiprotici, care, intocmai ca apa, au atat proprietati acide cat si bazice. Avand insa constante de autoprotoliza diferite de cele ale apei, domeniile de existenta ale echilibrelor protolitice sunt altele.
|
Dizolvantul |
Echilibrul protolitic |
pKauto. |
|
NH3 |
[NH2-][NH4+] |
22 |
|
C2H5OH |
[C2H5O-][C2H5OH2+] |
19 |
|
CH3OH |
[CH3O-][CH3OH2+] |
16 |
|
H2O |
[HO-][H3O+] |
14 |
|
HCOOH |
[HCOO-][HCOOH2+] |
6 |
|
H2SO4 |
[HS04-][HSO4H2+ |
3,2 |
Dupa cum s-a mai spus, asa numitul "ion de
hidrogen", H+, este, in solutie apoasa, un ion de
hidroniu, H3O+, in solutie alcoolica, un ion de
alcoxoniu, C2H5OH2+, in
solutie de amoniac lichid, un ion de amoniu, NH4+
etc. Toti acesti ioni sunt acizii conjugati ai
dizolvantilor respectivi functionand ca baze si se numesc ioni de lioniu. In mod similar, baze
conjugate ale dizolvantilor ex. HO-
in H2O, NH2- in NH3, C2H5O-
in C2H5OH etc. se numesc ioni de liat. ![]()
a) Dizolvanti bazici
Amoniacul lichid fiind o baza mai puternica decat apa, acizii slabi ( ionizati putin ) in apa, apar ca acizi tari ( ionizati mult ) in acest dizolvant. Astfel, acizii acetic, formic si azotic, care sunt de tarie mult diferita in apa, apar la fel de tari in solutie 0,1 n in amoniac, aciditatea lor fiind nivelata la limita superioara: activitatea catalitica a acestor acizi in
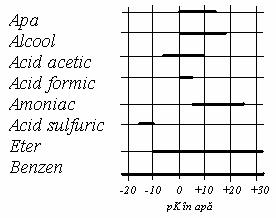
domeniile de existenta ale echilibrelor
protolitice in diferiti dizolvanti
NH3 lichid, care depinde de concentratia ( activitatea ) ionilor NH4+, este egala cu a acizilor clorhidrid, iodhidric si percloric, acizi care apar ca mult mai tari in solutie apoasa. Din aceeasi cauza, substante foarte slab acide, ca H2O, sunt relativ puternic ionizate in amoniac lichid.
In timp ce in amoniac lichid taria acizilor este plafonata de aciditatea ionului NH4+, pot exista in acest dizolvant baze mai tari decat ionul HO- (figura de mai sus), taria bazica fiind plafonata de ionul NH2-. Pe aceasta proprietate se bazeaza utilizarea amoniacului lichid ca dizolvant in unele sinteze.
b) Dizolvanti acizi
In dizolvantii mai acizi decat apa, bazele ( slabe ) sunt ionizate mai puternic, iar acizii ( tari ) sunt dimpotriva ionizati mai slab decat in apa.
Mult studiat ca dizolvant acid a fost acidul acetic. Toate bazele mai tari ( in apa ) decat anilina au curbe de titrare identice, ceea ce inseamna ca echilibrele sunt complet deplasate spre dreapta:
![]() B + CH3COOH BH+ + CH3COO-
B + CH3COOH BH+ + CH3COO-
Aminele alifatice ( mai bazice ), dizolvate in acid acetic, sunt puternic ionizate. Substante foarte slab bazice in apa, ca ureea, oximele si trifenilmetanolul, sunt baze de tarie masurabila in acid acetic. Pe acest fenomen se bazeaza o metoda analitica pentru titrarea bazelor prea slabe pentru a fi dozate in solutie in solutie apoasa. Titrarea se efectueaza in solutie de acid acetic, cu o solutie standard de acid percloric, in acelasi dizolvant. Punctul final se observa potentiometric sau cu un indicator adecvat ( de ex. colorantul cristal-violet ).
Acizii ionizeaza de asemenea in solutie de acid acetic, dar echilibrul este deplasat spre stanga, comparativ cu echilibrul similar din solutia apoasa:
![]() HA + CH3COOH A- + CH3COOH2+
HA + CH3COOH A- + CH3COOH2+
Prin masuratori de conductibilitate si de forte electromotoare, in solutie de acid acetic, s-au putut stabili urmatoarele aciditati relative ale catorva acizi obisnuiti ( se indica taria acida relativa fata de aceea a acidului azotic ):
HNO3< HCl < H2SO4 < HBr < HClO4
1 9 30 160 400
Dupa cum se vede, toti acesti acizi, care apar de tarie egala in solutie apoasa, se deosebesc in realitate mult in ceea ce priveste tendinta lor de a ceda protoni unei baze mai slabe decat apa (CH3COOH).
Printre dizolvantii acizi, acidul sulfuric se distinge prin puterea sa de solvatare a ionilor si constanta sa dielectrica enorm de mare , proprietati care favorizeaza reactiile ionice in acest dizolvant.
c) Taria relativa a acizilor si bazelor in dizolvanti diferiti
Intr-un anumit dizolvant, acizii se deosebesc prin taria lor, putand fi aranjati intr-o serie in ordinea constantei de aciditate. Experienta a aratat ca acizii isi pastreaza locul intr-o asemenea serie si atunci cand se schimba dizolvantul, cu alte cuvinte, tariile relative ale acizilor sunt independente de dizolvant. Aceasta generalizare este valabila numai pentru acizi cu acelasi tip de sarcina ( acizi fara sarcini, acizi cationici sau acizi anionici ).
d) Dizolvanti aprotici
O clasa de dizolvanti, printre care se numara hidrocarburi ca benzenul si hexanul sau compusi halogenati ca diclormetanul ( clorura de metilen ) si triclormetanul ( cloroformul ), nu pot nici a accepta nici a dona protoni. In asemenea dizolvanti aprotici nu au loc ionizari si nici reactii protolitice, decat daca solutia contine concomitent un acid si o baza. Cum acesti dizolvanti au constante dielectrice mici, ionii de semn contrar ce iau astfel nastere raman alipiti sub forma de perechi de ioni sau de asociatii ionice mai complicate. Din cauza acesta, studiul echilibrelor protolitice si al cineticii reactiilor ionice, in acesti dizolvanti, prezinta un caracter neobisnuit.
O mentiune speciala merita dizolvantii aprotici dipolari, numiti astfel fiindca poseda atomi de hidrogen atat de slab acizi incat nu pot forma legaturi de hidrogen ( cu anionii ), dar au constante dielectrice si momente electrice mari. Printre acesti dizolvanti se numara nitro-derivati (nitro-metanul, nitro-benzenul), cetone (acetona), amide alchilate (dimetilformamida, dimetilacetamida) si sulf-oxizi (dimetilsulfoxidul). Dizolvantii aprotici dipolari solvateaza in general bine cationii, dar nu solvateaza sau solvateaza foarte slab anionii. Datorita acestei proprietati, multe reactii catalizate de baze si alte reactii in care intervin anioni decurg cu viteza mult mai mare in dizolvantii aprotici dipolari decat in dizolvantii protici, de ex. in alcooli.