SINTEZA, PROPRIETATILE SI CHIMIA FLUORURII DE XENON
Lucrarea prezinta pe langa cateva informatii generale legate de chimia gazelor rare, o scurta trecere in revista a informatiilor de baza privind sinteza fluorurii de Xenon II, proprietatile fizice si chimice, solubilitatea in majoritatea solventilor anorganici, usor de manipulat si de utilizat in metodele spectroscopice (IR, Raman , RMN) pentru caracterizarea de compusi. Vom prezenta XeF2 ca agent oxidant. Reactiile de XeF2 cu diferiti acizi Lewis si formarea de XeF+ Xe2F3+ si sarurile sunt descrise pe scurt. Cea mai mare parte a acestei analize este de prezentare a XeF2 ca un ligand de ioni de metale. De altfel, sunt prezentate si diferite trasee pentru pregatirea de noi compusi de tipul [Mn + (XeF2)p] (AF6-) impreuna cu influenta cationului si anionului cu privire la caracteristicile structurale ale acestor compusi.
Este analizata si posibilitatea de prezicere a structurii acestor noi compusi, cunoscand doar proprietatile cationului si anionului.
Caracterizare generala a gazelor rare
Elementele din grupa 18(VIII) au avut in decursul timpului denumiri diferite, in functie de proprietatile observate fiind numite pe rand gaze rare sau gaze inerte; la aceste denumiri s-a renuntat datorita observatiilor experimentale: argonul nu poate fi considerat element rar (in atmosfera este mai raspandit decat CO2) iar inertia chimica a elementelor a fost infirmata odata cu descoperirea compusilor xenonului. Denumirea de gaze nobile este cea mai adecvata, deoarece reflecta o reactivitate chimica scazuta, dar semnificativa.
Proprietati atomice ale gazelor rare
Gazele nobile sunt gaze monoatomice de inalta simetrie moleculara, incolore, inodore si greu solubile in apa; solubilitatea acestora creste cu Z, deoarece in acelasi sens cresc polarizabilitatea invelisurilor electronice si taria fortelor interatomice. Desi configuratiile electronice ale gazelor nobile reprezinta edificii foarte stabile, numai in cazul heliului si al neonului acestea corespund unor invelisuri absolut complete, celelalte elemente avand orbitalii d neocupati care pot fi folositi pentru hibridizare si formarea unor legaturi chimice (tabel 3.1).
Tabelul 3.1. Proprietati atomice ale gazelor nobile
|
Proprietati |
He |
Ne |
Ar |
Kr |
Xe |
Rn |
|
Configuratii electronice |
1s2 |
He 2s22p6 |
Ne 3s23p6 |
Ar 3d104s24p6 |
Kr 4d105s25p6 |
Xe 4f145d106s26p6 |
|
Densitate (g/L) |
|
|
|
|
|
|
|
p.t./p.f. (°C) |
|
-245,9 |
|
|
|
|
|
Entalpia de evaporare (kJ/mol) |
|
|
|
|
|
|
|
Energia de ionizare (kJ/mol) |
|
|
|
|
|
|
|
Afinitate pentru electron (kJ/mol) |
|
|
|
|
|
|
|
Polarizabilitate medie (m3x1030) |
|
|
|
|
|
|
|
Electronegativitate (scara spectrochimica) |
|
|
|
|
|
|
|
Numere de oxidare |
|
|
|
|
|
|
Energiile de ionizare au valori foarte ridicate, fiind cele mai mari din perioadele din care fac parte gazele nobile, datorita configuratiilor electronice deosebit de stabile. Energia de ionizare a heliului are valoarea cea mai ridicata din Sistemul Periodic.
Afinitatile pentru electron au valori negative pentru toate gazele nobile deoarece acestea au nivele electronice complete.
Punctele de fierbere joase ale gazelor nobile usoare (He - Ar) se explica prin prezenta unor forte slabe de interactie intermoleculara (singurele forte care actioneaza sunt de tip London). Aceste forte cresc in grupa de sus in jos fiind direct proportionale cu polarizabilitatea atomilor si invers proportionale cu potentialele de ionizare ale atomilor.
Reactivitatea chimica a gazelor nobile este foarte limitata: numai Kr, Xe si Rn dau compusi cu fluor si oxigen. Reactivitatea chimica prezinta o usoara crestere in grupa, de sus in jos, odata cu descresterea energiei de ionizare si cresterea polarizabilitatii. Pe masura ce cresc numarul de ordine ai raza atomica, scad interactia nucleu-electron si energia de ionizare, crescand posibilitatea decuplarii si promovarii electronilor pe orbitalii liberi din stratul de valenta. Formarea orbitalilor hibrizi in special la xenon (si eventual radon) este consecinta acestor modificari progresive odata cu cresterea numarului de ordine. In cazul radonului posibilitatile de studiere a proprietatilor chimice sunt limitate de radioactivitatea acestuia.
In anul 1962 primul compus al gazului nobil, Xe[PtF6], a fost
sintetizat si era chimiei gazelor nobile a inceput. In anii care au urmat au fost scrise foarte multe
articole pe aceasta tema, de exemplu, articole stiintifice si ziare, iar asta
doar daca ar fi sa amintim cateva. Recentul articol pe care il prezentam arata
clar ca interesul legat de acest fascinant subiect nu s-a diminuat; dimpotriva,
putem vorbi chiar despre o renastere a chimiei gazelor nobile. Fluorura de
Xenon(II) este unul din compusii gazelor nobile usor de utilizat - prin urmare,
chimia sa este cea mai larga. Sinteza sa este relativ simpla si nu
exista nici un pericol de formare de oxizi ai xenonului explozivi sau cu
stari inalte de oxidare.
Scopul principal al acestei scurte revizuiri este de a oferi cateva
informatii de baza despre sinteza XeF2, proprietatile sale si
pentru a arata o mare varietate de posibilitati legate de acest reactiv.
Articolul este destinat celor care nu au cunostinte vaste in chimia gazelor
nobile sau nu au deloc cat si persoanelor de specialitate. Scopul nostru a fost
in primul rand sa ii punem in tema pe cititori in legatura cu existenta chimiei
gazelor nobile, in special chimia xenonului (II), si in al doilea rand, sa
subliniem ca XeF2 este extrem de reactiv, a carui utilizare este
mult mai extinsa decat s-a crezut.
Cea mai mare parte a acestei analize este consacrata de XeF2,
molecula care actioneaza ca un ligand de ioni de metale.
2.Sinteza si proprietatile XeF2
Fluorura de xenon (II) a fost prima raportata independenta de catre doua
laboratoare. XeF2 poate fi preparat din amestec de gaze xenon si
fluor, folosind diferite tipuri de energie, de exemplu, caldura, lumina UV,
lumina soarelui, descarcari electrice, radiatii de inalta densitate, iradiere de
electroni de la un accelerator van de Graff, iradiere de 10 MeV protoni etc. Daca se folosesc metode termice de preparare, se impune
folosirea unui exces de xenon, pentru a evita formarea fluorurilor superioare.
Una dintre cele mai elegante sinteze de XeF2 pentru obtinerea unui produs
pur fotochimic este o reactie a unui amestec de gaze xenon si fluor cu
exces de xenon. Reactia poate fi efectuata intr-un vas Pyrex. Amestecul este
expus la lumina directa a soarelui (Figura 1)
sau la lumina UV de la o lampa cu mercur. Foarte pur, XeF2 intr-o
cantitate mai mare (pana la 1 kg), poate fi cel mai bine pregatit prin iradiere
UV de xenon - fluor gazos, raportul amestecului molar xenon: fluor este de 2:1.
Reactia termica intre xenon si fluor pentru a forma difluoruri de xenon este
eterogena si are loc pe pereti prefluorurati au vasului de reactie. In timpul
studiului asupra efectului catalizator al unor fluoruri de metale tranzitionale
de ordin 2 pe reactia intre xenon si fluor, sa constatat faptul ca NiF2
este cel mai puternic catalizator. In prezenta NiF2 (pe o suprafata
de aproximativ 100 m2), este posibil de a sintetiza XeF6,
chiar si la 393 K de la amestecul molar de gaze xenon si fluor in cele mai
mici rapoarte (de 1:5). Desigur, reactia intre xenon si fluor poate proceda de
asemenea, ca reactie omogena, daca sunt suficienti radicali de fluor formati
din clipa in clipa in amestecul de xenon si fluor care este de altfel o reactie
puternic exoterma.

Figura 1. Sinteza fotochimica a XeF2
XeF2 este incolor ca solid, lichid sau gas. Presiunea vaporilor de
solid la 298 K este 6.0x102 Pa, ceea ce face posibil ca XeF2 sa fie
sublimat sub vid, la temperatura camerei. Punctul de topire al XeF2
este 402.18 K. Cristalele mari de XeF2 sunt, de obicei, formate la
temperatura camerei (figura 2). Pentru XeF2
au fost de identificate doua structuri: una liniara si una
centro-simetrica (D∞h)
cu ajutorul metodelor spectroscopice (vibratie in IR). Cea mai fiabila valoare
a lungimii de leagturi de Xe-F in faza
de vapori este de 197.73 ± 0.15 pm. Intr-un compus solid de XeF2,
fiecare atom de xenon are doi atomi de fluor la distanta de 200 pm si opt atomi
de fluor, la distanta de 342 pm fata de alte 8 legaturi de molecule XeF2
. Exista puternice interactiuni electrostatice intre moleculele de XeF2
. Ca aranjament structural sunt intr-o legatura mare cu enatlpia de sublimare
(55,71 kJ / mol) si si-a asumat taxa de distributie, in fiecare molecula (-0.5F-Xe
+1- F-0.5) .
Din modul de impachetare al moleculei in stare solida rezulta ca regiunea ecuatoriala a fiecarei molecul de XeF2 este evitata de liganzii fluorura din structuri vecine datorita elecetronilor Xe care protejeaza sarcina pozitica a moleculei.

Figura 2. Cristale de XeF2
XeF2
se dizolva intr-o varietate de solventi fara oxidare sau reducere, ca de
exemplu in BrF5, BrF3, IF5, HF anhidru, CH3CN,
etc. Solubilitatea in anhidru HF este destul de mare, in valoare de 167 g/100g
HF la 29.95 °C. In studiul de interactiune a XeF2 cu o varietate de
solventi "inerti', care sunt utilizati in chimia organica, s-a
constatat ca si schimbul de hidrogen si schimbul de clor-fluor are loc la un
timp relativ scurt in comparatie cu cloroformul, diclormetanul si
dibromometanul. XeF2 reactioneaza lent cu tetraclorometanul si
fluorotriclormetanul, in timp ce in acetonitril rata de reactie este
neglijabila.
Benzile de vibratie de XeF2 in solide
si in vapori sunt:
In solide: este la 496 cm-1 (1,0), R; este la 547 cm-1 (VS), IR; existenta structurii de retea este confirmata prin prezenta benzii de la 108 cm-1.
In vapori: este la 516.5 cm-1 (1,0), R; este la 213.2 cm-1 (VS), IR; este la 560.1 cm-1 (VS), IR si este de la 1070 cm-1, IR.
Spectroscopia RMN a devenit un instrument de precizie in caracterizarea structurala a speciilor de xenon in solutie si in ultima vreme de asemenea, in stare solida. Iata cateva date despre spectroscopia RMN pentru XeF2: (129Xe) (ppm): -2074 (in faza de gaz, 90 s C), de la -2009 la -1592 (in diversi solventi), -1604 ± 10 (in stare solida la 0sC); (19F) (ppm): -183,4 (in faza de gaz, 90 sC), de la -181.8 la -199.6 (in diversi solventi), 169 ± 1 (stare solida 0°C); 1J (129Xe-19F) (Hz): 5627 (in faza de gaz, 90 sC) , de la -5579 la -5652 (in diversi solventi) -5550 ± 50 (in stare solida la 0°C).
Compusii xenonului cu fluor si oxigen
Xenonul reactioneaza direct cu F2 (de obicei, in aparatura de nichel, pasivat prin expunere in atmosfera de fluor) si formeaza compusi in stari de oxidare +2, +4, +6 si +8. In conditii diferite de lucru (raport molar, temperatura si presiune) se obtin compusi diferiti, dintre care unii sunt foarte stabili. Moleculele acestora, XeF2, XeF4, XeF6 si XeF8 au structuri diferite, care se pot interpreta prin modelul RPESV.
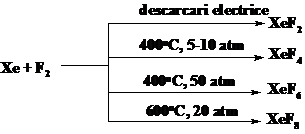
Formele spatiale ale compusilor XeFn
|
Compus |
Forma spatiala |
|
|
XeF2 |
|
AB2E3 (Xe, sp3d) Liniara |
|
XeF4 |
|
AB4E2 (Xe, sp3d2) plan patrata |
|
XeF6 |
|
AB6E (Xe, sp3d3) bipiramida patrata deformata |
|
XeF8 |
|
AB8 (Xe, sp3d4) bipiramida hexagonala |
Reactiile fluorurilor xenonului se aseamana foarte mult cu cele ale halogenurilor de halogen; cele mai interesante sunt prezentate in tabelul urmator:
Reactivitatea chimica a XeFn
|
Disproportionare |
2XeF2 XeF4 + Xe 3XeF4 2XeF6 + Xe |
|
Oxidare |
XeFn + nKI n/2I2 + Xe + nKF 2XeF2 + Pt + 2HF H2 PtF6 + 2Xe XeF2 + SF4 SF6 + Xe XeF6 + 3H2 Xe + 6HF |
|
Hidroliza (reactii violente) |
XeF2 + H2O Xe + 1/2O2 + 2HF 3XeF4 + 6H2O 2XeO3 + Xe + 12HF XeF6 + H2O XeOF4 + 2HF XeF6 + 6H2O H6XeO6 + 6HF XeF6 + 3H2O XeO3 + 6HF XeF8 + 4H2O XeO4 + 8HF XeF8 + 6H2O H4XeO6 + 8HF |
|
Bazicitate si Aciditate Lewis |
XeF2 + SbF5 XeF+ SbF6 XeF4 + 2SbF5 XeF3+·Sb2F11- XeF2 + MF5 2XeF2·MF5 sau XeF2·2MF5 (M=As, Sb) XeF6 + RbF Rb+ XeF7 |
|
Reactii de fluorurare |
XeF6 + SiO2 SiF4 + XeO2F2 |
Di-, tetra- si hexafluorurile xenonului pot actiona ca donori, prin atomii de fluor. De exemplu, XeF6 cu acizi Lewis ca AsF5, SbF5 formeaza aducti, dintre care unii se considera ca au structuri ionice.
XeF2·2MF5 XeF4·2SbF5
2XeF2·MF5 XeF3+·Sb2F11-
Prin reactia dintre xenon si PtF6, a fost obtinut primul compus, Xe[PtF6], din care se pot obtine si alte fluoruri complexe:
Xe + PtF6 ![]() Xe PtF6
Xe PtF6
XePtF6 + PtF6 XeF-PtF6-
+ PtF5‑
![]() XeF+Pt2F11-
XeF+Pt2F11-
XeF6 + RbF Rb XeF7 ![]() M2XeF8 + XeF6
M2XeF8 + XeF6
Sarurile M2XeF8 cu metale alcaline sunt cunoscute, indeosebi cele ale Rb si Cs care sunt bine caracterizate.
Prima sinteza adevarata a unui compus chimic avand in componenta un gaz nobil
ca element, Xe[PtF6], a declansat imediat intrebarea daca modelele
anterioare de legatura sunt inca valabile. Raspunsul a fost pozitiv. A fost
imediat clar ca aceleasi modele pot fi aplicate atat pentru interhalogeni si
halogen cat si pentru oxo specii. Sau aplicat doua abordari in ceea ce priveste legatura:
modelul legaturii oribitalilor moleculari (MOM)
repulsia perechilor de electroni din stratul de valenta (RPESV).
Urmeaza punerea in aplicare a celor doua modele, in cazul XeF2.
a) Metoda orbitalilor moleculari (MOM)
Acest model nu implica electronii din stratul exterior (de valenta), cel putin nu intr-o masura care ar putea
afecta in mod semnificativ energia de legatura. Apropierea simpla a orbitalilor moleculari
afiseaza legatura in termeni de trei-centrii ai orbitalilor, derivate dintr-un
orbital "p" de la fiecare dintre perechile de atomi participante. Combinatia a celor
trei orbitali atomici prevede trei orbitali moleculari: unul de legatura , unul
de nelegatura si unul de anti-legatura. Un atom contribuie cu doi electroni si
fiecare din liganzii de fluor cu doar un electron la acest sistem de orbitali
moleculari p , ajungandu-se astfel ca patru electroni sa ocupe
acesti orbitali. Orbitalul de legatura cu cea mai mica energie primeste
doi electroni. Orbitalii de nelegatura cu energia intermediara primeste de
asemenea, doi electroni. Orbitaliul molecular cu cea mai mare energie ramane
neocupat. In consecinta exista legaturi nete, care sunt
cele mai bune in cazul in care aranjamentul de trei atomi este centro-simetric.
Simetria moleculara D∞h
de XeF2 este in armonie cu aceste cerinte. Nelegaturile orbitalilor
sunt concentrate in mare masura, pe liganzii fluorului, mai precis pe
restabilirea densitatii de electroni. Perechea de electroni de legatura este
responsabila pentru legarea impreuna a tuturor celor trei atomi. Delocalizarea
perechilor de electroni este cel mai bine descrisa in prezentarea -0.5F-Xe +1-
F-0.5. Aceasta repartizare se potriveste proprietatilor fizice si
chimice ale XeF2. Este de remarcat, totusi, ca legaturile de
xenon-fluor in XeF2 sunt, de fapt, legaturi simple.
Se poate concluziona ca ramane adevarat ca aranjamentul electronilor in gazele
nobile este un aranjament stabil, pe care toti atomii elemenentelor
netranzitionale le pot atinge sau mentine. Xenon nu face exceptie de la aceasta
regula.
b) Repulsia perechilor de electroni din stratul de valenta
(RPESV)
Coulson a favorizat schema legaturii de
valenta, sistem care ar putea fi prezentat ca rezonanta intre doua forme
canonice F-Xe+ F- si F‑ Xe+-F.
In acest model ionic fiecare atom este inconjurat de un octet de electroni. Se presupune ca fiecare legatura intre
ligandul F si atomul Xe implica o pereche de electroni. In continuare se
presupune ca toate nelegaturile de valenta ale electronilor ar avea un efect
steric. Folosind modelul Gillespie s-a incercat sa se presupuna forma la toate
speciile necunoscute la acea vreme, previziunile sale confirmandu-se ulterior
in momentul in care aceste specii au fost izolate.
Modelele de legatura si calculele de proprietati fizice si spectroscopice ale
XeF2 fac obiectul unor publicatii recente.
3. XeF2 ca fluorura si agent oxidant
XeF2 are potential considerabil pentru reactii de fluorare oxidativa
datorita valorilor mici ale energiilor de legatura (133,9 kJ / mol). Cu
toate acestea s-a demonstrat ca XeF2 are o stabilitate cinetica
considerabila , de exemplu, poate fi recuperat din solutie apoasa, in care
acesta este termodinamic instabil in urma hidrolizei, prin extractie cu CCl4
sau prin distilare fractionara.
Formarea de specii cationice Xe (II), de exemplu, XeF+, Xe2F3+
in anhidru HF ca solvent si in prezenta de acizi Lewis, face XeF2
chiar mai puternic din punct de vedere al fluorurarii si al oxidarii. Afinitatea pentru electron a XeF+
si Xe2F3+ este mai mare decat cea a XeF2
si transferul de electroni la oricare din acesti cationi ar genera radicalul XeF ., rezultand
astfel o sursa importanta de fluor. Fluorurile mai slabe, halogenurile si
complexele de halogenuri, oxizii si carbonilii din mai multe elemente pot fi
oxidati cu XeF2 in anhidru HF. De exemplu, elemente cum ar fi Ni,
Hg, Mo, Nb, Os pot fi oxidati, fie pentru a forma floruri binare (NiF2,
HgF2) sau derivati ai XeF2 (NbF5, OsF5).
Florurile mai joase precum TlF, SnF2, AsF3, MnF2,
CoF2, MoF4, CrF2 sunt oxidate la TlF3,
SnF4, AsF5, MnF3, CoF3, MoF6,
CrF4. Produsii de oxidare a halogenurilor si a halogenurilor
complexe MoBr4, RuCl3, OsBr4, KWF6
si K3RhF6 sunt fluoruri in stari superioare de
oxidare, MoF6, RuF5, OsF5, WF6 si K2RhF6.
Oxifluoririle sau fluoruri sunt principalele produse de oxidare ai unor oxizi ca SO2, ReO2, RuO2. La temperatura camerei XeF2 nu reactioneaza cu pulberi de UO2, U3O8 sau ZrO2. Reactia poate fi indusa sa aiba loc precum in aer fara incalzire, prin adaugarea unei picaturi de apa. Dupa ce initial reactia este lenta, ea devine una violenta. Produsele de reactie sunt fie fluoruri de metal fie oxifluoruri. Sistemul XeF2-HF este util pentru pregatirea fluorurilor metalelor carbonile de tranzitie , fie prin oxidare directa a carbonililor (de exemplu, Mo(CO)6 la Mo(CO)3F3, Os3(CO)12 la cis-[Os(CO)4F2], Ru3(CO)12 pentru a cis-[RuF2(CO)4] sau cu halogen de schimb (de exemplu, Ru(CO)3Cl2 la Ru(CO)3F2 si Ru(CO)2F3).
Inca nu iesim din
aria proprietatilor oxidante ale XeF2 in solutie apoasa. Cloratii,
bromatii si iodatii pot fi oxidati la compusii in stare de oxidare +7
(perhalogenati). Este, de asemenea, capabila sa oxideze clorura la
clor, iodur si iodat la periodat, Ce(III)
la Ce(IV), Ag(I) la Ag(II), etc . In solutii acide XeF2 este capabil
de oxidare Pu(III) la Pu(IV) si in continuare la Pu (VI).
XeF2 poate fi folosit ca agent de fluorurare pentru fulerene. A fost
demonstrat, ca fluorarea de Th-C60Br cu XeF2
in anhidru HF, la temperatura camerei a dus la formarea de Th-C60F24.
In afara de utilizarea XeF2 pentru fluorurarile de substante
anorganice, ne trebuie, de asemenea, sa mentionam larga utilizare in chimia
organica. Este un excelent reactiv pentru introducerea de atomi de fluor in
moleculele organice. Acest lucru nu este scopul acestei analize, prin urmare,
nu vom intra in detalii. In afara de aceasta, mai multe comentarii au fost
scrise excelent care acopera acest subiect.
Mentionam pe scurt un alt exemplu de oxidare al XeF2, si anume
abilitatea de utilizarea sa ca reactiv de gravare pentru siliciu si compusi ai
siliciului dar si pentru metale ca aluminiu, cupru, aur dar si pentru unii polimeri. XeF2 ataca siliciu intr-o faza de gaz, la temperatura
camerei, cu extrem de mare selectivitate a numeroase materiale inclusiv de
dioxid de siliciu si multe alte metale. Avantajul de a folosi XeF2
ca reactiv de gravare este ca produsele finale ale procesului de gravare sunt
gaze, SiF4 si Xe care se elimina din sistem. In prezent se
comercializeaza echipamente pentru gravura de XeF2.
Scopul acestui capitol este de a oferi cititorului o idee despre cat de extins
este domeniul XeF2 care actioneaza ca un agent oxidant si
fluorurant.
Bazicitatea Lewis se
explica prin caracterul de bun donor de electroni prin ionii F- . XeF2
este un donor de electroni de ioni fluorura. Capacitatea donarii ionilor a
fluorurii in ceea ce priveste fluorurile binare este: XeF6> XeF2>>
XeF4. Aceasta constatare este in acord cu entalpiile de ionizare
(XeFx (g) → XeFx-1 + (g) + F-(g); H0
pentru XeF2 = 9.45 eV, H0 pentru XeF4 = 9.66 eV
si H0 pentru XeF6 = 9.24 eV ). Fluorurile care au putere
mare de acceptare de ioni, de exemplu, AsF5, SbF5, BiF5
poate retrage o fluorura de ioni de la XeF2 formand specii de
XeF+, precum si in cazul de exces de XeF2 peste acidul
Lewis. In molecula libera de XeF2 legatura intre xenon si fluor este
o legatura de un electron. Daca un ion de fluorura este luat de la XeF2,
legatura care ramane intre Xe si restul de F, devine mai puternica. Cresterea
energiei legaturii in Xe-F in cation (133,9 kJ / mol in XeF2 la
195.9 kJ / mol in cation) contribuie la capacitatea ionului donor, fluorura, sa
diflorureze. XeF2 formeaza de asemenea compusi in care captarea de
ionului fluorura de la molecula XeF2, molecula care se alfa in prima
faza de ionizare: XeF2
→ XeF+ + F-. In acesti compusi contributia
legaturii covalente este substantiala.
Compusii Xe(II) se pot obtine prin topirea amestecurilor stoechiometrice ale
componentelor in atmosfera inerta sau prin dizolvare in solventi corespunzatori
(soventi neoxidanti sau reducatori). Unul dintr componente poate fi de asemenea
in exces.
Intentia de analiza a compusilor cu XeF2 este de a arata de
posibilitatile pe care le ofera.
4.1. Reactii ale XeF2 cu pentafluoruri
Compusii ai pentafluorurilor cu XeF2 sunt cei mai frecvent
intalniti. Pana in prezent, au fost gasite trei tipuri de compusi: 2 XeF2
∙ MF5, XeF2 ∙ MF5 si XeF2
∙ (MF5). Doua tipuri de legaturi au fost sugerate pentru
acesti compusi: ionice (de exemplu, XeF+
MF6-sau Xe2F3+ MF6-)
formularea si cazurile in care contributia covalentei este foarte importanta si
molecula este coordonata la MF5 prin asa legatura cu fluor. Tipul de
legatura este puternic dependenta de pentafluorile utilizate. Gradul de
ionizare in acesti compusi variaza in functie de aciditatea Lewis a
pentafluorurii. Caracterul ionic mai puterinc din legatura al XeF2
este de gasit in cazurile acizilor Lewis extrem de tari precum SbF5
si BiF5.
In reactiile a diferitelor pentafluoruri cu exces de XeF2, compusii
din compozitia 2 XeF2∙MF5 (M = Ca, Sb, Bi, Ta, Ru,
Os, Rh, Ir, Pt, Au) au fost izolati. Cei mai multi dintre acestia au fost
caracterizati prin spectroscopie RAMAN. Benzile, caracteristice pentru
vibratiile ale Xe2F3+(legatura Xe-F se
intinde) sunt, de obicei, foarte intense. Caracteristica de dublet este gasita
in regiunea de aproximativ 580 la 600 cm-1. Gradul de intindere al
Xe-F se afla la aproximativ 100 cm-1 mai mare din punct de vedere al
frecventei la fel ca si in solide XeF2 si este legata de vibratiile
scurte Xe-F de legaturi in cation.
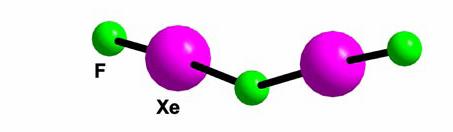
Figura 3. Structura in forma de 'V' a cationului Xe2F3- in compusii Xe2F3AF6 (A = As, Sb, Ru)
Compusii XeF2:MF5 cu raportul molar de 1:1 (XeF+MF6-) si cu XeF2:MF5 cu raportul de 1:2 (XeF+M2F11-) au fost obtinuti in cea mai mare parte din metalele mentionate mai sus. Molecula libera XeF2 este liniara si simetrica, in timp ce in cazurile de compusi cu acizi Lewis MF5 (M = Ca, Sb, Bi, Ta, Ru), molecula XeF2 este distorsionata. Distanta Xe∙ ∙ ∙ F este puternic alungita, fapt care arata ca XeF2 a donat ion fluorura la MF5 (acceptor) pentru a genera anionii MF6- si M2F11- . In cazul compusilor cu puternica acidiate Lewis (de exemplu, AsF5, SbF5, BiF5, TaF5, RuF5) benzile din regiunea 596 - 619 cm au fost atribuite vibratiilor simetrice ale legaturilor simple Xe-F. Cea mai distorsionata molecula de XeF2 dintre acesti compusi este in XeFSb2F11 cu o banda (Xe-F) in spectrul Raman la 620 cm- . Structurile cristaline de XeFAsF6 si XeFRuF6 pot fi mentionate aici (Figura 4). Distantele Xe-F scurte sunt 187.2 pm (Ru) si 187.3 pm (Ca), in timp ce distantele Xe ∙ ∙ ∙ F alungite sunt 218.2 (Ru) si 221.2 pm (Ca). Aceste cazuri demonstreaza in mod clar ca molecula XeF2 in acesti compusi este la sfarsitul treptei sale de ionizare: XeF2 → XeF+ + F-.
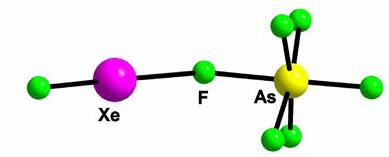
Figura 4. Structura XeFAsF6
Aductii moleculari de XeF2 cu pentafluoruri sunt, de asemenea, cunoscuti. Unul din primele exemple este XeF2∙IF5, care a fost caracterizat prin spectroscopie RAMAN, banda pentru XeF2 a fost gasita la 493 cm-1, care arata ca doar XeF2 nedistorsionat a fost prezent in complex.
Un alt astfel de exemplu este XeF2∙VF5. Interactiunea dintre XeF2 si VF5 este atat de slaba, incat chiar fasciculului IR poate descompune XeF2∙VF5 in componentele sale in faza de vapori. Aductii XeF2∙2BrF5 si XeF2∙9BrF5 au fost postulate in functie de compozitia diagramei punctelor de topire.
4.2. Reactii de XeF2 cu tetrafluorurile
Numarul compusi cu tetrafluorurile nu este la fel de ridicat ca si in cazul
pentafluorurilor. Varietatea rapoartelor molare intre
compusii XeF2 si MF4 variaza in felul urmator 4:1 - 1:2 . Tetrafluorirle de Ti, Cr, Mn, Rh, Pd, Pt,
Sn si chiar XeF4 formeza compusi cu XeF2. Tetrafluoririle
sunt mai slabe ca pentafluorile din punctul de vedere al acizilor Lewis, prin
urmare, compusii cu cationii Xe-F+ sau Xe2F3+
si compusii cu anionii MF5 MF62- nu sunt chiar
asa de comuni, sau mai bine zis nu au mai nimic in comun. In sistemul XeF2/CrF4
au fost gasiti doi compusi care au fost structural analizati si caracterizati :
XeF2∙CrF4 (Figura 5)
si XeF2 ∙ 2CrF4.
Compusii pot fi preparati prin reactia dintre CrF5 si exces de XeF2 de la 323-333K. CrF5
se reduce la CrF4, in timp ce XeF2 este oxidat la XeF4,
produsul final este XeF2∙CrF4 si este albastru.
Acest produs de inceput este, de asemenea, compusul de pregatire a cristalelor
XeF2∙2CrF4, incalzind proba intr-un recipient
termic sau prin recristalizarea lui din SF6. In ambele structuri de
XeF2 moleculele sunt distorsionate cu distante de nelegatura Xe-F,
distantele variind de la 190.3 la 193 pm si legaturile Xe-F, distantele variind
de la 212.7 la 218.6 pm. Legaturile de Xe-F distantele si analiza RAMAN ( (Xe-F), la
574 cm-1 pentru XeF2 ∙ CrF4) indica
faptul ca XeF2 este la inceputul treptei de ionizare mentionate
anterior.
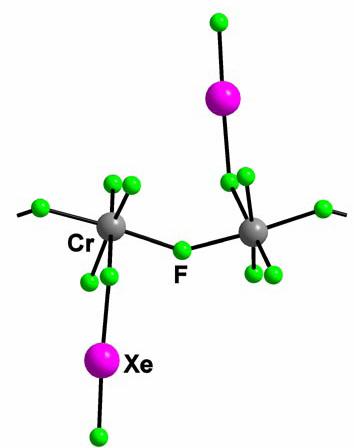
Figura 5. Structura XeF2∙CrF4
4.3 XeF2 in compusi cu ioni fluoarura slab acceptori
Aductii cu ioni slab acceptori fluorura MoOF4 si WOF4
sunt, de asemenea, cunoscuti. In acesti aducti XeF2 interactioneaza
cu centrul metalic. In structura de cristal XeF2∙WOF4,
distantele de legatura in XeF2 (189 pm si 204 pm) indica, ca
molecula XeF2 este distorsionata dar contributia covalenta la
legatura este esentiala.Frecvente RAMAN( (Xe-F)), pentru aceste doua componente
sunt 575cm-1 (Mo) si 585cm-1 (W) . In (XeF2)2∙
XeF5+AsF6, XeF2∙XeF5+AsF6-
si XeF2∙2(XeF5+AsF6-)
ligandul F incarcat negativ al moleculelor XeF2 interactioneaza cu
atomii Xe incarcati pozitiv ai cationilor XeF5+. Structural si
analiza RAMAN de date arata ca interactiunea dintre XeF2 este
considerabil mai slaba la fel ca in cazurile acizilor Lewis mai puternici . In
XeF2∙2(XeF5+AsF6-)
molecula XeF2 creeaza doua poduri intre unitatile XeF5+AsF6-
devenind aproape nedistorsionabile (Xe-F distanta 203 pm, (Xe-F), la
496 cm-1). In alte doua cazuri moleculele XeF2 sunt
nelegate si, prin urmare, are loc denaturarea distantelor ((XeF2)2∙
XeF5+AsF6: Xe-F : Pm 205, 199 pm si 201
pm, (Xe-F) 550 si 542 cm-1;
XeF2∙XeF5+AsF6: Xe-F
distantele: 200 pm, 197: pm, (Xe-F) 559 cm-1.
5. XeF2 ca un ligand coordonare de compusi
In ultimii ani a fost sintetizata o noua serie de compusi cu XeF2
ca ligand la ionii de metal. Primul compus XeF2 care a fost legat
direct de metalul central a fost de [Ag (XeF2)2](AsF6)
. Ulterior investigatia sistematica a reactiilor a Mn+ (AF6-)n
(M este de metal in stare de oxidare n, A = Ca, Sb, Bi, P, Ta, Ru) cu XeF2,
a fost realizata cu HF anhidru ca solvent. Detalii despre sinteze si
caracteristicile structurale ale coordonarii compusilor cu atom central
univalent M+ (M = Ag , Li), cu metale alcaline pamantoase (Mg-Ba) ,
cu alte metale M2 + (M = Cd, Cu , Zn, Pb) si metale lantanide Ln3+
pot fi gasite In literatura de specialitate. Compusul Cd cu anionul BF4-
[Cd (XeF2)] (BF4)2 ar trebui sa fie de
asemenea mentionat.
Exista doua posibilitati care ar trebui sa fie luate in considerare pentru a
sintetiza noi compusi de coordonare cu XeF2 ca un ligand al ionilor
metalici:
1.) Cationii metalici ar trebui sa fie relativ acizi Lewis slabi pentru a
preveni retragerea F‑ de la molecula XeF2 si astfel
face posibila generarea sarurilor de Xe2F3+AF6-
sau XeF+ AF6-.
2.) XeF2 dizolat in HF anhidru este agent de oxidare foarte puternic
; binenteles este esential ca si cationul metal sa fie rezistent mai departe in
viitoarele oxidari. Daca cationii metalici sunt oxidati acestia sunt
transformati in acizi Lewis mai puternici ,precum si posibilitatea ca acestia
se vor retrage F‑ de la molecla XeF2 este chiar mai
mare.
5.1. Trasee sintetice pentru pregatirea compusilor [Mn+(XeF2)p](AF6-)n
Urmatoarele rute sintetic ar putea fi aplicate pentru elaborarea de coordonare
a compusilor de tipul [Mn+(XeF2)p](AF6-)n:
1.) Reactia intre Mn+(AF6-)n si
exces de XeF2 in anhidru HF ca solvent.
Dupa ce reactia a fost finalizata excesul de XeF2 si solventul au
fost pompate in afara. Produsul de reactie a fost monitorizat prin
spectroscopie RAMAN. In acest fel, de asemenea, la temperatura camerei s-au
detectat produse instabile. Cand intinderile simetrice al virbatiilor ( 1), din
molecula libera de XeF2 la 497 cm-1 sunt fost absent
e clar ca restul de XeF2 este
delimitat. In cazul magneziului , 1 a moleculelor libere de XeF2
a disparut la compozitia [Mg(XeF2)6](AsF6)2.
Acest compus coordinativ nu este stabil la temperatura camerei, pierde usor XeF2,
compusul [Mg(XeF2)4](AsF6)2, care a
fost posibil sa izoleze la temperatura camerei si chiar sa se obtina
sub forma de monocristal. Acest compus pierde si el lent XeF2,
la temperatura camerei stabile [Mg (XeF2)2](AsF6)2.
2.) Reactia intre Mn+(AF6-)n si
sumele stoichiometrice de XeF2 in HF anhidru.
Acest traseu sintetic este utilizat in cazurile in care compusul izolat are in
continuare vapori de descompunere , presiunea XeF2 este la
temperatura camerei si in parte s-ar putea descompune in timp ce excesul de XeF2
este pompat in afara. Prin folosirea sumelor stoechometrice a ambilor reactivi
este obtinut un produs pur.
3.)Traseul sintetic direct
In cazurile fosfatilor sau boratilor o ruta sintetica directa ar putea fi
aplicata deoarece PF5 si BF3 nu sunt acizi Lewis
suficienti de puternici pentru a forma acizi Lewis stabili XeF+,
saruri. In sinteza directa, reactia se efectueaza intre MFn si XeF2
in HF anhidru acidifiat cu exces de PF5 sau BF3.
5.2. Tipurile de XeF2 ca ligand
Molecula XeF2 ca un ligand in coordonarea compusilor de tipul [Mn+(XeF2)p](AF6-)n
actioneaza fie ca ligand cu pozitie terminasa sau in punte conectand doi centri
de metal. In primul caz este
XeF2 doneaza o fluorura de
ioni metalului central. Mediul simetric din atomul de xenon este distorsionat.
Distanta de legatura dintre atomul de xenon si ionul fluorur donat de cationul
metalic creste si distanta dintre terminale (non-bridging) ionul fluorura si
atomul de xenon scade. Alungirea benzii RAMAN a legaturii scurte de Xe-F se
situeaza intre 544 si 584cm‑1. In punte molecula XeF2
, ambii ioni de fluorura interactioneaza cu doi metali centrali diferiti.
Distanta legaturii Xe-F se schimba doar putin, dar se intinde banda Raman a Xe-F de la 500 la 535 cm-1.
De sporire a prezentei se intinde de la frecventa 496 cm‑1 la
535 cm-1 este asociat (1) cu interactiunile dintre metalul central
si molecula de XeF2 si (2) cu
un grad ridicat de Coulomb in care acest metal central este plasat.
Transformarea libera a moleculei XeF2 prin etapa in care XeF2
este o molecula care actioneaza ca un ligand de ionizare completa XeF2
in XeF+ F- si este prezentat in figura
6.
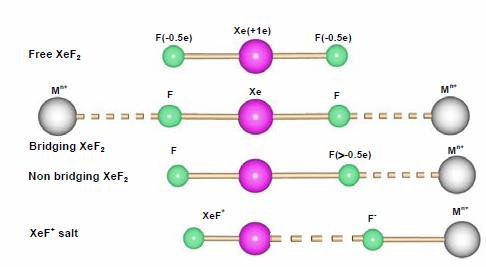
Figura 6. XeF2 in timpul ionizarii de la molecula simpla la cationul XeF+
Numarul de molecule XeF2 (bridging si non-bridging) in jurul unui metal central pot varia de la o molecula XeF2 non-bridging in [Cd(XeF2)](BF4)2 pana la noua molecule XeF2(5 non-bridging si 4 bridging) in jur de un atom Ca in [Ca2(XeF2)9](AsF6)4.
In timpul reactie dintre Mn+(AF6-)n si XeF2 in anhidru HF este influentat cationul Mn+ si aciditatea Lewis esentiale pentru cursul reactiei. Compusii coordinativi de tipul [Mn+ (XeF2)p](AF6-)n vor fi formati doar in cazurile cand aciditatea Lewis a Mn+ nu este destul de mare de a se retrage din ionii fluorura de la XeF2 formand MFn si Xe2F3+ AF6-. De exemplu, in cazurile de compusilor Ni(AsF6)2 si Mn(AsF6)2, aciditatea Lewis a Ni2+ este destul de mare de a se retrage ionii fluorura din XeF2 formand NiF2 si Xe2F3+ AsF6- , in timp ce in cazul manganului, Mn2+ este oxidat la Mn3+ care este acid Lewis mult mai puternic. Chiar si mai interesanta este situatia in seria lantanidelor. In partea de inceput a seriei de la La la Gd Ln3+ sunt acizi Lewis slabi si [Ln(XeF2)p](AsF6)3 compusii coordinativi s-au format. Exceptiile sunt Ce, Pr si Tb care sunt oxidati la Ln4+ pentru a forma astfel acizi Lewis mai puternici decat Ln3+ si produsele finale sunt LnF4 si Xe2F3+ AsF6-.
In mijlocul seriei al Ln (Dy, Ho) aciditate
Lewis a cationului este 'la granita'; ambele reactii au avut loc: LnF3
si [Ln(XeF2)p](AsF6)3 s-au format
in acelasi timp.In seria Er-Lu sunt izolate doar produsele LnF3 si
Xe2F3+AsF6-.
Impactul cationului pe structura diversificata (vezi pct. 5.5) a acestor
compusi coordinativi este determinat de o parte din proprietatile sale de
exemplu afinitatea electronului, sarcina nucleara reala, volum reala, aciditatea
Lewis a cationului , covalenta legaturii M-F, numarul de coordinatie etc. Influenta cationului este vazuta in mod clar in cazul
compusilor [M(XeF2)4](AsF6)2, cu M
= Mg,Ca,Cd. Anionul si
numarul de molecule XeF2 pe atom central sunt aceleasi in toate cele
trei cazuri. Structura cristalului [Mg (XeF2)4](AsF6)2
reprezinta prima structura moleculara de tipul non-punte a ligandului XeF2. Tipul structurii este o
consecinta a unui ion Mg2+
si prin urmare, un numar de coordinatie scazut de a Mg (NC = 6) si
covalenta legaturii Mg-F. Sarcina electronului transferata de la molecula XeF2
la cation ca urmare a caracterului covalent al legaturii Mg-F cedeaza moleculei
XeF2 mai putin capabile , o punte intre doi cationi de magneziu In cazul compusului [Mg(XeF2)2](AsF6)2
(Figura 7) unde mai putine molecule de
XeF2 sunt disponibile, din
nou, doar molecule non-punte XeF2 sunt prezente. Coordinatia in
jurul metalului central este realizata de catre puntea cis a anionului formand
un lant.
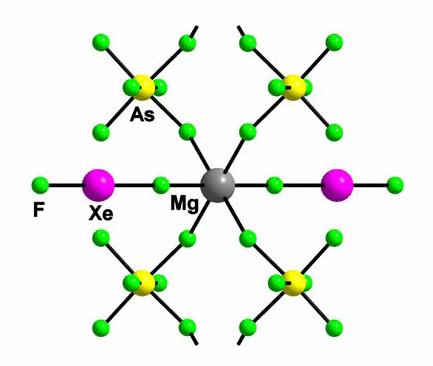
Figura 7. Exemplu de metal coordinat prin nelegatura moleculelor de XeF2 ; [Mg(XeF2)2](AsF6)2
Cationii Ca2+ si Cd2+ sunt mai mari si numarul de coordinatie (NC = 8 (Ca), 9 (Cd)) creste in comparatie cu Mg2+. Desi dimensiunea Ca2+ (126 pm) si Cd2+ (124 pm) sunt similare, afinitatile pentru electroni nu sunt (Ca2+: 11.87 eV; Cd2+: 16.91 eV). In conformitate cu afinitatea pentru electroni mult mai mare a Cd2+ o sarcina mai mare transferata de la molecula XeF2 la ionul metalic si prin urmare, un grad mai mare al covalentei in legatura M-F de , este de asteptat in cazul compusului Cd decat in cazul compusului Ca. Acest lucru face interactiunile puntii in structura Cd mai putin favorabile. In compusul [Cd(XeF2)4](AsF6)2 sunt numai doua punti in molecula XeF2, care rezulta in lantul de aranjament de cristal, in timp ce in [Ca(XeF2)4](AsF6)2 exista patru punti in molecula XeF2 obtinerii unui strat structura (Figura 8).
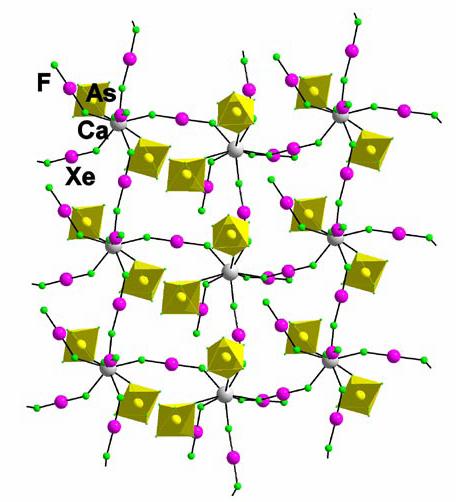
Figura 8. Structura de lant in [Ca(XeF2)4](AsF6)2
Este evident ca numai cu schimbarea de cation trei structuri diferite de cristal au fost obtinute: moleculara, lant si strat structura. In toate cele trei structuri de numai moleculele XeF2 sunt conectate la metalul central. Alaturi de metalele alcalino-pamantoase cationul Mg are doar non-punte moleculele XeF2 , in compusi cu Ca2+ ambele tipuri sunt prezente (non-punte si punte XeF2) (Figura 9), in timp ce XeF2 in cazurile Sr si Ba (Figura 10) este mai capabil de interactiuni de punte. Motivul pentru aceste caracteristici structurale este ca in cadrul metalelor sarcina nucleara reala a atomului central se micsoreaza si ca o consecinta a acestui, transferul de sarcina de la molecula XeF2 la ionul metalic este mai mic, aceasta facand ca moleculele de XeF2 sa fie capabile sa ceeze mult mai usor legaturi.
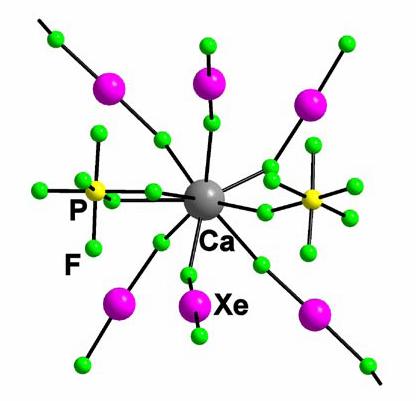
Figura 9. Exemplu de metal coordinat prin nelegatura si legatura moleculelor de XeF2 ; [Ca(XeF2)5](PF6)2
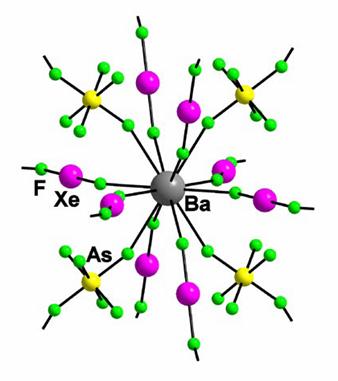
Figura 10. Exemple de metale coordinate prin legatura moleculelor de XeF2 ; [Ba(XeF2)5](AsF6)2
5.4. Influenta anionul in compusii de tipul [Mn+(XeF2)p](AF6-)n
cu privire la structurile lor
Impactul anionului AF6- asupra diversitatii structurale a
compusilor coordinativi este mai putin important, fata de influenta cationului.
Urmatoarele proprietati ale anionului AF6‑ ar trebui sa fie luate in considerare:
bazicitate Lewis a AF6-, sarcina F- a
ligandului AF6. Diferentele in proprietatile cationului
determinat si anionul care guverneaza comportamentul structural al acestor
compusi coordinativi sunt uneori foarte subtili si prin urmare, este dificil,
daca nu chiar imposibil de prevazut ce tip de structura vor adopta compusii
coordinativi.
In randul PF6, AsF6,
SbF6, BiF6 ligandul F in acesti anioni AF6 are sarcini negative diferite. In PF6 sarcina negativa a
ligandului F este cea mai mare si in SbF6
si BiF6 sarcina negativa a ligandului F este cea mai mica. Acest
lucru poate fi demonstrat in urmatoarele exemple. In compusul [Cd(XeF2)](BF4)2
incarcarea negativa a ligandului F din anionul BF4 anion este mai
mare ca si in cazul anionului AF6, din cauza numarului mai mic
de liganzi F.
5.5. Diversitatea structurala in clasa compusilor coordinativi
Sfera de coordinare a cationlior metalici este, de obicei, compusa din
molecule XeF2 (doar legaturi sau nelegaturi sau ambele tipuri de XeF2)
si anionii AF6. Iata cateva exemple rare de cationi coordinati doar
de moleculele de XeF2: [Ca2(XeF2)9](AsF6)4
(Figura 11) si [M(XeF2)6](SbF6)2
(M = Zn, Cu) .
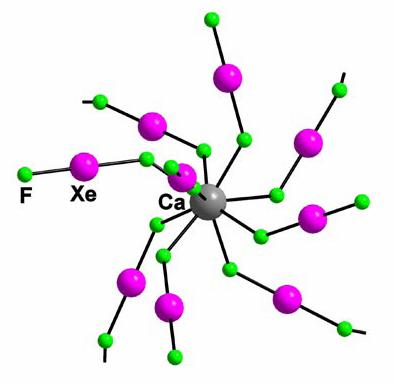
Figura 11. Exemplu de metal coordinat numai de XeF2 (prin legatura si nelegatura) ; centru de Ca2+ in [Ca2(XeF2)9](AsF6)4
Compusii de coordonare de tipul [Mn+(XeF2)p]
(AF6-)n expun tipuri de structuri diferite:
structura moleculara [Mg(XeF2)4](AsF6),
structura dimerica [Cd2(XeF2)10](SbF6)4
, structuri de lanturi (de exemplu, [Ca(XeF2)5](PF6)2,
[Cd(XeF2)4](AsF6)2 ), structura
lant dublu [Nd(XeF2)2,5](AsF6)3),
strat simplu (ca de exemplu, [Ca (XeF2)4] AsF6)2),
dublu strat [Pb(XeF2)3](AsF6)2,
[Sr(XeF2)3](AF6)2 ( A = As,75P),
retea 3D [Ca(XeF2)2,5](AsF6) 2, [Ag(XeF2)2](PF6).
XeF2 este un reactiv sintetic util in chimie anorganica. Sinteza sa este
relativ simpla si accesibila, chiar si pentru laboratoarele de anorganica mai
slab echipate. XeF2 este un agent oxidant si fluorurant puternic.
Cationii XeF+ si Xe2F3+ formati in acid HF anhidru sau in sarurile
XeF+ si in Xe2F3+ sunt oxidanti mai
puternici decat moleculele neutre de XeF2. Una dintre principalele
sale utilizari in ultimii zece ani este prepararea unei serie destul de
extinse de noi compusi coordinativi cu XeF2 ligand de ioni de
metale. XeF2 este un excelent ligand datorita caracterului
semi-ionic si de dimensiunilor mici (65 A3). Recent, peste treizeci de compusi
coordinativi noi s-au sintetizat si caracterizat structural. Influenta cationului
si anionului in acesti compusi interesanti este elucidata.