Importanta Proteinelor
Proteinele reprezinta un numar mare de compusi organici constituiti din aminoacizi uniti prin legaturi peptidice, ce formeaza organisme vi si sunt esentiale pentru functionarea lor. Descoperite in 1838, proteinele sunt acum recunoscute ca fiind principala componenta a celulelor vii, insemnand mai mult de 50 la suta din greutatea "uscata" a animalelor. Cuvantul proteina vine din grecescul proteinos care inseamna principal.
Moleculele proteice variaza de la fibre lungi si insolubile care formeaza tesutul de legatura si parul, pana la globule solubile ce pot trece prin membranele celulare si pot cataliza reactii metabolice. Sunt specifice fiecarei specii si fiecarui organism. Oameni au aproximativ 30.000 de proteine diferite, din care doar 2 la suta au fost pe deplin analizate. Proteinele din dieta, sunt folosite in principal pentru a construi si pentru a mentine celule, dar descompunerea lor chimica da de asemeni energie, apropiindu-se de cele 4 calori pe gram, generate de hidrocarbonati (eng.: carbohydrates).
Pe langa functiile lor in crestere si in mentinerea celulelor, proteinele sunt de asemeni responsabile pentru contractia muschilor. Enzimele digestive sunt proteine, asa cum este insulina si multi alti hormoni, anticorpii sistemului imunitar si hemoglobina, care transporta substante vitale prin corp. Cromozomii, care transmit caracteristicile ereditare, sub forma de gene, sunt de asemeni compusi din acizi nucleici si proteine.
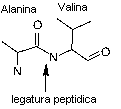
Indiferent daca sunt gasite in
oameni sau in bacterii unicelulare, proteinele sunt compuse din aproximativ 20
de aminoacizi diferiti, care, pe rand sunt formate din carbon, hidrogen,
oxigen, azot si cateodata sulf.
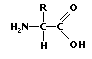
Intr-o molecula de
proteina, acesti acizi formeaza legaturi peptidice, (ce sunt legaturi intre
gruparile amino (NH ) si carboxil (COOH) ), ce
creeaza lanturi lungi peptidice.
Numarul aproape infinit de combinatii pe care acesti acizi se alinieaza, si forma elicoidala sau globulara sub care aceste lanturi se formeaza ajuta la explicarea enormei diversitati de functiuni pe care proteinele le indeplinesc.
Pentru a sintetiza proteinele esentiale vietii, fiecare specie are nevoie de anumite proportii din cei 20 de aminoacizi. Desi plantele pot produce toate componentele de care au nevoie plecand de la azot, dioxid de carbon si alte elemente chimice, prin fotosinteza, majoritatea celorlalte organisme pot produce doar o parte din ele. Cele care raman, trebuie sa fie derivate din mancar. Opt aminoacizi esentiali sunt folositi pentru a mentine starea de sanatate a unui organism: leucina (eng. :leucine ) izoleucina, lisina (eng: lysine), metionina (eng:methionine), phenialanina (eng: phenyalanine), teonina (eng:theonine), triptofan (eng:tryptophan) si valina. Toti acestia sunt disponibili in proteinele produse de semintele plantelor, dar deoarece plantele nu au de obicei concentratii prea mari de lisina si triptofan, expertii in nutritie recomanda suplimentarea dietei cu proteine animale, din carne, oua, si lapte.
Majoritatea dietelor, mai ales in tarile dezvoltate, cum ar fi Statele Unite ale Americi, unde proteina animala este consumata in exces, contin toate proteinele necesare. Kwashiorkor, o boala prezenta printre copii din Africa centrala se datoreaza carentei unui anumit aminoacid. La adulti se recomanda 0.79g de proteina pe kilogram ( din greutatea corporala), in fiecare zi. Pentru copii sau sugari cantitatea se dupleaza si respectiv se tripleaza datorita cresterii lor rapide.
Lanturile polipeptidice sunt aranjate in asa fel incat acizii hidrofobi de obicei sunt orientati catre interior, dand stabilitate moleculei, iar cei "iubitori de apa" sunt orientati catre exterior unde pot interactiona cu alti compusi si in special cu alte proteine. Proteinele globulare in particular pot interactiona cu un compus anume de exemplu un derivat al unei vitamine formand astfel coenzime, sau se pot uni cu o anumita proteina pentru a forma un ansamblu de proteine folosit de celula.
Colagenul, care formeaza oasele, pielea, tendoanele si cartilajele, este cea mai abundenta proteina gasita la vertebrate. Molecula contine de obicei trei lanturi polipeptidice foarte lungi, fiecare format din aproximativ 1000 de aminoacizi, care se rasuceste intr-o forma regulata de elice tripla (triplu-helix) si dau astfel tendoanelor si pielii puterea de rezistenta la tensiune. Cand fibre lungi de colagen sunt denaturate prin fierbere, lanturile se scurteaza, si formeaza gelatina.
Keratina, care compune stratul exterior al pielii umane, parul si unghiile, solzii si penele animalelor se rasuceste intr-o forma numita alpha-helix. Ele protejeaza corpul de mediu, keratina fiind complet insolubila in apa. Multele legaturi disulfurice o fac o proteina extrem de stabila, ce poate rezista actiunii enzimelor proteolitice (eng.:Proteolytic (protein-hydrolysing)). In tratamentele de permanentizare a parului uman, acesta este supus unui agent de reducere cum ar fi tioglicol (eng:thioglycol), pentru a reduce numarul de legaturi disulfurice, care sunt mai tarziu refacute cand parul intra in contact cu oxigenul.
Fibriogenul este o proteina plasmatica a sangelui, responsabila pentru coagularea sangelui. Cu actiunea catalitica a trombinei, fibriogenul se transforma in molecule insolubile care se unesc intre ele pentru a forma aglomeratii de proteine.
Proteine musculare , cum este miozina sunt responsabile pentru contractiile muschilor, combinate cu actina, o alta proteina musculara formeaza actomiozina. Diferitele filamente ale actomiozinei se scurteaza, producand astfel contractia muschilor.
Spre deosebire de proteinele fibroase, proteinele globulare sunt sferice si foarte solubile. Ele joaca un rol dinamic in metabolismul corpului. Exemple ar fi albumina, caesina (eng:caesin) ,globulina, hemoglobina, si alte enzime si hormoni proteinici. Albumina si globulina sunt clase de proteine solubile abundente in celulele animale, in serul din sange, in lapte, si in oua. Hemoglobina(eng: haemoglobin) este o proteina cu rol in respiratie care transporta oxigen in corpul uman si este responsabila pentru culoarea rosie a celulelor rosii din sange. Mai mult de 100 de tipuri de hemoglobina umana, au fost descoperite, printre care hemoglobina S, cauza anemiei "sickle-cell", boala ereditara suferite in special de negrii.
Hormoni proteinici sunt proteine ce provin din glandele endocrine, nu functioneaza ca si enzimele, stimuland organele tinta in a initia si a controla actiuni importante cum ar fi rata metabolismului si producerea de enzime digestive si de lapte. Insulina, secretata de pancreas, regleaza nivelul de glucoza din sange. Tiroglobulina secretata de granda tiroida, regleaza metabolismul general, hormonul calciton (eng: calcitonin), secretat tot de glanda tiroida, reduce nivelul de calciu din sange.
Microtuburi
Proteinele globulare pot de asemeni sa se aseze intr-o forma de tub, goala prin interior, care foloseste si la intarirea peretilor celulari cat si la conducerea substantelor de la o celula la alta. Fiecare din aceste microtuburi este format din toua tipuri aproape sferice de proteine, care formeaza o pereche si se unesc la capatul de crestere al unui microtub, lungind-ul daca este necesar. Aceste tuburi sunt de asemeni prezente in membrele ciliare cu care unele microorganisme se deplaseaza (flageluri). In fiecare cil sau flagel, noua perechi de microtuburi inconjoara o a zecea pereche centrala.
Acizii nucleici, sunt molecule extrem de complexe, produse ce celulele vii, si de virusi. Numele lor vinde de la pozitia lor in celulele vii. Cativa acizi nucleici insa, nu se gasesc in nucleu ci in citoplasma celulei. Acizii nucleici au cel putin doua functii: sa treaca caracteristicile ereditare de la o generatie la alta si sa produca proteine specifice. Cum reusesc acizii nucleici sa efectueze aceste functii este obiectul celei mai intese cercetari ale zilelor noastre. Se crede ca s-au format acum trei milioane de ani cand cele mai elementare forme de viata au aparut pe pamant. Originea codului genetic, a fost acceptata de cercetatori ca fiind foarte apropiata de cea a vietii insasi.Biochimistii au reusit sa descifreze codul, adica sa determine cum acizii nucleici dicteaza structura proteinelor.
Asa cum chimistul suedez jons Jakob Berzelius a sugerat in 1823, enzimele sunt catalizatori, capabili sa accelereze o reactie chimica, fara a fi consumate de proces.
Unele enzime cum ar fi pepsia si tripepsina, care folosesc in digestia carnii, controleaza multe reactii diferite, iar altele cum ar fi ureasa sunt extrem de individualizate, si pot controla o singura reactie. Altele elibereaza energia necesara inimii pentru a bate si pentru contractiile pulmonare. Multe faciliteaza conversia zaharului si mancarurilor in diverse substante necesare corpului pentru creearea de noi tesuturi, pentru refacerea celulelor sangelui, si pentru energia necesara muschilor pentru a se contracta.
Pepsina, tripepsia si alte enzime au de asemeni proprietatea ciudata numita autocatalizare, care permite creerea lor dintr-un precursor numit zimogen, ca o consecinta, aceste enzime pot fi reproduse intr-o eprubeta.
Enzimele sunt extraordinar de eficiente, mici cantitati ale acestor enzime pot efectua la temperaturi reduse reactii ce ar avea nevoie de reactanti foarte violenti prin orice metode chimice obijnuite. Cam 30 de grame de pepsina cristalizata, de exemplu, este capabila sa digere aproape doua tone (metrice) de oua in cateva ore.
Cinetica reactiilor enzimelor divera fata de reactiile simple, anorganice. Fiecare enzima este specializata pentru reactia pe care o supravegheaza, si lucreaza la o temperatura anormala pentru acea reactie in mod normal. Chiar daca o crestere in temperatura poate accelera o reactie, enzimele sunt instabile cand sunt incalzite. Activitatea catalitica a enzimei este determinata in principal de catre succesiunea de aminoacizi si de structura tertiara (asezarea tridimensionala a ramurilor macromoleculei). Multe enzime necesita prezenta altor ioni sau altor molecule, numite cofactori, pentru a functiona.
Ca o regula generala, enzimele nu ataca celulele vii. Imediat ce o celula moare, este imediat digerata de catre enzimele care descompun proteinele. Rezistenta celulei vii este data de inabilitatea enzimei de a trece prin membrana celulara cat timp celula traieste. Cand celula moare, membrana ei devine permeabila si astfel enzima poate intra in interiorul celulei si poate distruge proteinele din ea. Cateva celule contin inhibatori de enzime, numite si antienzime, care impiedica actiunea enzimelor pe un anumit substrat.
Fermentatia acoolica si alte procese industriale importante depind de actiunea enzimelor sintetizate de catre drojdia si bacteriile folosite in procesul de productie. Un numar de enzime este utilizat in industria medicala. Cateva au fost utilizate cu succes in tratarea zonelor de inflamare locale, tripsina este folosita pentru a elimina materia straina si celulele moarte din rani si arsuri.
Cercetarile in chimia enzimelor in ultimii ani a aruncat o alta lumina asupra catorva functii de baza ale vetii. Ribonucleaza (eng. Ribonuclease), o enzima simpla tridimensionala, a fost descoperita in 1938 de catre bacteriologul american Rene Dubos, izolata in 1946 de catrechimistul american Moses Kunitz, si sintetizata de catre cercetatori americani in 1969. Sinteza presupune unirea a 124 de molecule intr-o ordine foarte bine definita, pentru a forma o macromolecula. Astfel de sinteze au dus la probabilitatea de a identifica acele zone ale moleculei care actioneaza chimic asupra altor substante. Astfel de sinteze au dus la probabilitatea sintetizarii unor enzime cu proprietati care nu sunt prezente in natura. Aceast potential al enzimelor a fost foarte puternic exploatata in ultimii ani de catre tehnici ale ingineriei genetice, care fac posibila producerea enzimelor in mari cantitati.
Utilizarile medicale ale enzimelor sunt ilustrate de cercetari in L-asparaginase (eng.), care se considera a fi o arma potentiala in tratarea leucemiei, in cercetarea dextrinazei, care poate preintampina degradarea dintilor, si enzimele care nu se mai manifesta corect, care stau la baza unor boli cum ar fi phenilketunoria (eng.) anemia si alte dezechilibre ale sangelui.
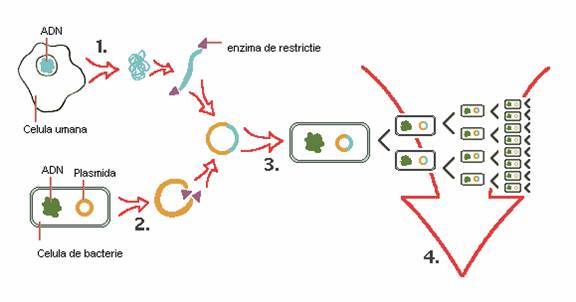
In ingineria genetica, cercetatorii folosesc enzime de restrictie pentru a izola un segment de ADN, care contine o gena de interes, de exemplu gena care regleaza producerea insulinei.
O plasmida extrasa din bacterie, si tratata cu aceleeasi enzima de restrictie poate hibrida cu fragmentul "lipicios" de ADN complementar.
Plasmida hibrida este reincorporata in celula de bacterie, unde se multiplica, ca parte a ADN-ului celular.
Un numar mare de celule fice poate fi cultivat pentru produsul genetic care poate fi extras pentru utilizarea lui la oameni.
Proteine de receptare.
Suprafata celulelor are de obicei proteine care primesc informatia din jurul celulei. De exemplu, pe suprafata celulelor nervoase, a neuronilor, substante chimice numite neurotransmitatoare, se ataseaza la acesti receptori si provoaca celula sa genereze un semnal electric.
Proteine de recunoastere
La majoritatea animalelor proteinele numite MHC, permit celulelor sa se recunoasca intre ele. Aceste proteine sunt o componenta importanta a sistemului imunitar.
Importanta proteinelor in tratamentul cancerului.
Cercetatorii de la UW Medical School au descris importante date despre proteinele care detecteaza si repara informatia genetica distrusa dintr-o celula.
Aceasta descoperire demonstreaza ca principala cauza a mutatiei genetice ereditare care marea extrem de mult riscul de a contracta cancer, numita Sindromul Nijmegen Breakage (NBS). Aceasta este o boala destul de rara, similara si probabil in legatura cu boala mult mai comuna numita ataxia telangiectasia (AT). Pacientii cu aceste doua boli sunt extrem de succeptibili de cancer, si starea lor se va agrava foarte rapid daca nu intreprind tratamente cu radiatii. In viata de zi cu zi, celulele primesc un grad moderat de alterari ale cromozomilor, datorita expunerii lor la substante chimice din mediul inconjurator, la radiati si la produsi secundari naturali ai reactiilor chimice din corpul uman. Celulele urmaresc constant cromozomii, activad sisteme de reparare a ADN-ului atunci cand el este detectat. Aceste sisteme de reparare a ADN-ului sunt de asemenea responsabile de reglarea recombinarii ADN-ului intr-un proces de remodelare si diversificare a informatiei genetice. Un ADN cu probleme poate arunca celulele intr-o transformare puternica, si rezultatul poate fi devastator, ducand ulterior la cancer.
Celulele din pacienti de NBS si AT, prezinta cromozomi fragili si se pare ca ei nu mai pot recuoaste erorile de ADN.
MR95, un complex format din patru proteine este cel ce controleaza repararea si recombinarea ADN-ului. Au fost izolati cu succes trei dintre cele patru proteine. Se lucreaza de asemenea la un inlocuitor al acestui complex. Este surprinzator ca aceste proteine au capacitatea de a localiza si de a initia extrem de rapid repararea sectiunilor afectate ale ADN-ului. Se preconizeaza ca in urmatorii ani se va ajunge la o metoda de a neutraliza din start orice forma de cancer care este provcata de aceasta imposibilitate de reparare a ADN-ului.
Bibliografie:
Microsoft Encarta
University of Wisconsin-Madison Protein Database