HIDROCARBURI AROMATICE MONOCICLIECE
Starea naturala. Benzenul C6H6 se gaseste in titei, respectiv in benzine aromatice, din care se extrage.
Metode de preparare. In cantitati mari, benzenul se obtine prin distilarea fractionata a gudroanelor rezultate la distilarea uscata a carbunilor de pamant, si anume din uleiul usor. Benzenul se poate obtine sintetic prin polimerizarea acetilenei (sinteza ciclului) si prin aromatizarea catalitica a unor fractiuni de titei.
Proprietati fizice. Benzenul este un lichid, fara culoare, cu miros caracteristic, placut. Este mai usor decat apa, in care se dizolva foarte putin, solubil in alcool si eter; fierbe la 800C. Este un bun dizolvant pentru fosfor, sulf, iod, cauciuc, grasimi, rasini si multe alte substante organice.
cuantice si proprietatile chimice ale benzenului (caracterul aromatic)
In anul 1865, fr. Aug. Kekule tinand seama de formula bruta moleculara a benzenului (C6H6), de tetravalenta carbonului, de monovalenta hidrogenului si d e alte constatari experimentale a propus ca formula structurala pentru benzen un ciclu hexagonal regulat, alcatuit din sase atomi de carbon situati in varfurile hexagonului si legati intre ei prin trei duble legaturi conjugate, repartizate simetric, fiecare atom de carbon fiind legat, la randul sau, de un atom de hidrogen:
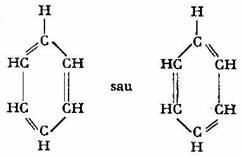
Conform acestei reprezentari structurale, benzenul este o ciclohexatriena.
O astfel de structura ar fi trebuit sa confere benzenului un caracter pronuntat nesaturat si proprietatea de a polimeriza usor.
In realitate, benzenul se comporta ca o hidrocarbura cu pronuntat caracter saturat dand reactii de substitutie, iar in putine reactii manifesta caracter slab nesaturat dand reactii de aditie, numai in conditii speciale.
Fata de oxidanti, benzenul este stabil, degradandu-se numai in conditii foarte energice.
Spre deosebire de hidrocarburile nesaturate, benzenul rezista chiar la temperatura de 9OO0C, manifestand stabilitate termica ridicata.
Toate proprietatile benzenului, observate in diverse reactii, nu concorda deplin cu formula de structura data de catre Kekule.
Experimental s-a dovedit ca prin inlocuirea unui singur atom de hidrogen din ciclul benzenic cu un substituent, de exemplu cu un atom de halo gen (C1), se obtine un singur derivat monosubstituit al benzenu-lui, indiferent de atomul de hidrogen care a fost inlocuit (in mod obisnuit benzenul este reprezentat numai prin legaturi]e simple si duble ale ciclului fara a se mai scrie simbolurile elementelor, formula simplificatii):
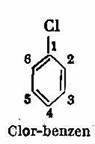
Aceasta dovedeste ca pozitia fiecarui atom de hidrogen nu se deosebeste cu nimic de pozitia celorlalti atomi de hidrogen, ceea ce inseamna ca in molecula benzenului toate cele sase pozitii - CH sunt echivalente intre ele.
Cand insa, in molecula benzenului se introduce al doilea substituent, atunci derivatul disubstituit 1,2 (orto) care se obtine ar trebui, dupa formula data de Ksku1s, sa se prezinte sub forma a doi izomeri a si b:
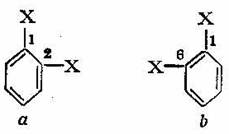
Din cele doua formule se observa ca cei doi izomeri a si b se deosebesc prin faptul ca, in primul izomer a, cei doi substituenti notati cu X se gasesc grefati pe doi atomi de carbon uniti printr-o legatura simpla, iar in al doilea b, ei se afla grefati pe doi atomi de carbon uniti printr-o legatura dubla.
Deoarece in practica nu s-a constatat existenta acestor doi izomeri, Kekule a facut presupunerea ca in nucleul benzenic, cele trei duble legaturi conjugate nu isi pastreaza pozitia fixa, ci se deplaseaza in mod continuu dand nastere Ia doua formule care se gasesc in echilibru dinamic:
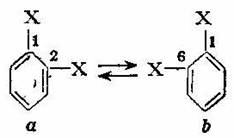
De aici rezulta ca legaturile 1,2 si 1,6 sint echivalente.
Cercetarile moderne privind studiul benzenului prin metoda radiatiilor X si a difractiei electronice au aratat configuratia de hexagon regulat a moleculei benzenului, asa cum a fost propusa de Kekule si ca cei sase atomi de carbon sint asezati in plan, la distante egale de 1,39 A, valoarea intermediara intre legatura simpla dintre doi atomi de carbon C-C (1,54 A) si legatura dubla C C dintr-o hidrocarbura alchenica (1,33 A).
Din cele aratate rezulta ca, in molecula benzenului, legaturile dintre atomii de carbon sint de un tip special, din care cauza hidrocarburile aromatice au proprietati deosebite de celelalte hidrocarburi.
In lumina consideratiilor fizico-chimice moderne (teoria mecanicii cuantice) s, formula ale structura a benzenului propusa de Ksku1s a fost revizuita in scopul asigurarii unei mai mari concordante intre proprietati si structura.
In ultimul timp, pentru benzen, s-au propus urmatoarele formulari:
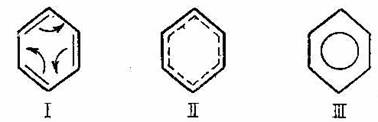
In prima formts1a (I), sagetile arata deplasarea electronilor p(pi), electroni mai slab legati de nucleu, mai mobili, a caror deplasare creeaza pozitiile intermediare intre cele doua forme a si b care se gasesc in echilibru dinamic; in formula (II), linia punctata si respectiv linia neintrerupta in formula (III) reprezinta distributia uniforma a celor sase electroni p(pi) in nucleul benzenic, formand un nor de electroni comun, si care corespund celor trei duble legaturi clasice (asa numitul "sextet de electroni" respectiv "sextetul aromatic").
Datorita acestei distributii uniforme, a celor sase electroni p intre atomii de carbon ai ciclului, rezulta echivalenta legaturilor carbon-carbon (C - C), cum si stabilitatea ciclului benzenic, ca urmare a unei atractii mai mari a electronilor de catre atomi. Totusi, pentru simplificarea reprezentarii moleculei de benzen, in mod curent se foloseste formula clasica a lui Kekule, cu specificarea ca dublele legaturi din ciclul benzenic nu sint legaturi etilenice, deoarece formandu-se un sistem de conjugare continua p, care se intinde pe intregul parcurs al sistemului hexagonal (sistem ciclic), ele au un caracter special intermediar intre cele doua tipuri de legaturi simple si duble.
Revenind la derivatii disubstituiti ai benzenului, trebuie adaugat faptul ca ei pot avea, in raport cu pozitia respectiva, trei forme izomere, previzibile teoretic si confirmate in practica.
De exemplu, in cazul derivatilor dibromurati ai benzenului se cunosc urmatorii trei izomeri:
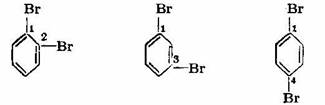
1 ,2-Dibrom-benzen 1,3-Dibrom-benzen 1,4-Dibrom-benzer
(o-dibrom-benzen) (m-dibrom-benzen) (p-dibrom-benzen)
Acesti izomeri formulati in schema de mai sus, se noteaza fie cu cifre: derivati 1,2; derivati 1,3 si derivati 1,4; fie utilizand denumirea foarte uzuala: orto, meta si para sau prescurtat o-, m-, p.
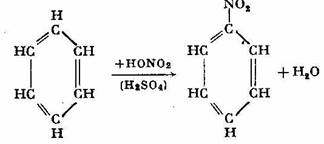
Benzenul reactioneaza usor cu acidul azotic concentrat in amestec cu acidul sulfuric si da nastere la un derivat nitric, nitrobenzenul:
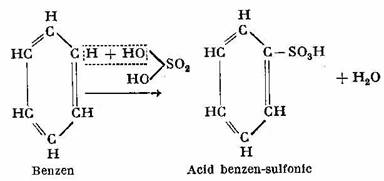
Cu acidul sulfuric concentrat formeaza un derivat substituit si anume acidul benzen-sulfonic:
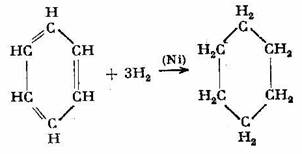
Dintre numeroasele reactii ale benzenului se cunosc si cateva reactii de aditie, caracteristice hidrocarburilor nesaturate, reactii care dovedesc existenta dublelor legaturi din molecula sa. Astfel, benzenul aditioneaza in prezenta de catalizator sase atomi de hidrogen si da ciclohexan:
Prin condensarea clor-benzenului cu aldehida triclor-acetica (cloral in prezenta de H2S04 concentrat rezulta p, p' -diclor-difenil-triclor-etan denumit prescurtat D.D.T, conform ecuatiei:
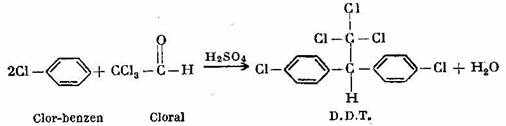
D.D.T. este un insecticid intrebuintat impotriva daunatorilor agricoli si este cunoscut sub numele detexan.
Aditia halogenilor (C1, Br, I) la benzen se face in prezenta radiatiilor ultraviolete sau a luminii solare; de exemplu prin actiunea clorului asupra benzenului, in prezenta luminii solare (clorurare fotochimica) se obtine hexaclor-ciclohexanul sau prescurtat H.C.H.:
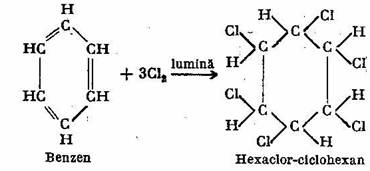
Hexaclor-ciclohexanul este numit si hexacloran sau gamexan si este folosit ca insecticid.
Acad. prof. Dr. C.D.Nenitescu si Dr. Alice Glatz au realizat in 1951 sinteza hexacloranului, in intuneric, in prezenta azo-izobutjronitrilului ca promotor
Intrebuintari. Benzenul este intrebuintat in sinteza colorantilor, medicamentelor, a parfumurilor, ca dizolvant organic, la prepararea omologilor sai superiori: toluen, xileni prin reactia Friedel-Crafts, la prepararea insecticidelor: D.D.T, gamexan etc.
Orientarea substituentilor in nucleul benzenic. Dupa cum s-a mai aratat, prin inlocuirea unui singur atom din nucleul benzenic cu un sub-stituent3 oarecare, se obtine un singur derivat monosubstituit, indiferent de atomul de hidrogen care a fost inlocuit. Aceasta arata echivalenta tuturor celor sase atomi de hidrogen din nucleul benzenic. Daca derivatii monosubstituiti ai benzenului sunt supusi unor noi reactii de substitutie, atunci pozitia in care intra cel de-al doilea substituent (substituirea ulterioara) va fi dirijata dupa natura primului substituent (a celui preexistent). Sa presupunem un nucleu benzenic monosubstituit si sa numerotam atomii de carbon incepand de Ia cel pe care se gaseste grefat substituentul:
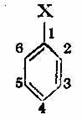
Atomii de carbon 2 si 6, adica cei situati in imediata apropiere a atomului de carbon cu hidrogen substituit, sint echivalenti si constituie pozitia orto; atomii de carbon 3 si 5 sint de asemenea echivalenti si constituie pozitia meta, iar atomul de carbon 4 constituie pozitia para.
In cazul unui derivat disubstituit, se obtine:
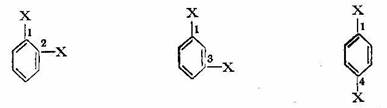
Derivat Derivat Derivat
orto-disubstituit meta-disubstituit para-disubstituit
S-a dovedit experimental ca substituentul preexistent clin nucleul benzenic indep1ineste un rol de dirijare (orientare) a substituentului urmator, prin aceea ca el determina o distributie inegala a densitatii electronice in diferite pozitii ale nucleului.
Substituentii preexistenti in nucleul benzenic (aromatic) se clasifica in doua categorii dupa pozitiile in care orienteaza cea de-a doua substituire.
1. Substituenti de ordinul I care orienteaza substituirea ulterioara in pozitiile orto si para.
Dintre acestia fac parte: halogenii (F, Cl, Br, I), grupele alchil -CH3 (in general -CnH2n+1) -OH, -NH2.
De exemplu, in cazul nitrarii fenolului, substituentul preexistent (grupa - OH) fiind de ordinul I, orienteaza intrarea celui de-ai doilea substituent (grupa - N02) in pozitiile orto (1,2) si para (1,4), rezultand un amestec de o- si p- nitro-fenoli.
2. Substituenti de ordinul II, care orienteaza substituirea ulterioara in pozitia rneta. Din seria substituentilor de ordinul 11 fac parte: - NO2, -SO3H, -COOH, -CHO, -CsN.
De exemplu, in nucleul aromatic al benzenului se pot introduce pana la trei grupe - NO2' acestea orientandu-se intre ele in pozitia meta, deoarece grupa - N02 este substituent de ordinul 11 (v. p. 413).
Benzenul si omologii sai au formula generala CnH2n-6. Cei mai importanti omologi ai benzenului sunt: metil-benzenii, cunoscuti sub numele de toluen si xileni.
Omologii benzenului se obtin prin inlocuirea unuia sau a mai multor atomi de hidrogen din molecula benzenului cu radicali alchilici. Astfel, prin substituirea unui singur atom de hidrogen eu radicalul metil -CI-13 se obtine metil-benzenul sau toluenul:
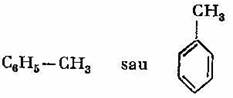
Deoarece in molecula benzenului toate grupele CH sunt echivalente, toluenul nu prezinta izomeri de pozitie.
Cand se inlocuiesc doi atomi de hidrogen prin radicali metil, se obtin trei izomeri de pozitie, numiti izomeri orto, meta si para.
Uneori, pozitia radicalilor substituiti poate fi indicata prin cifre si, in acest caz, atomii de carbon din nucleul benzenic se numeroteaza de la 1 la 6.
Exemple:
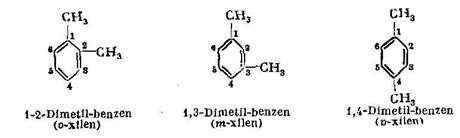
P - Xilenul este intrebuintat ca materie prima pentru fabricarea fibrei sintetice numita terilea sau teron.
Bibliografie:
Risavi, I., Ionescu, I.: «Chimie si Probleme de Chimie», E.T., Bucuresti, 1971.
Nenitescu, C.D.: "Chimie Organica", vol. 2, editia VII, EDP, Bucuresti, 1973.