![]()
In decursul anilor in care am invatat chimie am efectuat o serie de reactii chimice care au fost reprezentate prin ecuatii stoechiometrice. In acestea indicandu-se reactii si produsi de reactie. In marea majoritate a acestora transformarea reactantilor in produsi avea loc intr-un foarte scurt timp. Un studiu atent al reactiei chimice arata totusi ca in alte cazuri este nevoie de un interval de timp apreciabil pentru atingerea starii finale. Toate fenomenele ce se petrec in timp se caracterizeaza prin viteza.
II. TEORIA CIOCNIRILOR. COMPLEX ACTIVAT. ENERGIA DE ACTIVARE.
Teoria ciocnirilor se refera la intalnirea reactantilor pentru a forma o reactie chimica. In general, pentru ca o reactie chimica sa se produca, este necesar ca o serie de legaturi dintre particule sa se rupa, iar altele sa se formeze. Conform teoriei cinetico-moleculare, particulele constituente ale materiei sunt intr-o continua miscare avand energii diferite. Inlumina acestei teorii, redistribuirea legaturilor chimice are loc in urma ciocnirii dintre particulele reactante. Nu toate dintre particulele reactante sunt eficace, astfel incat sa conduca la produsii finali de reactie. Particulele care se ciocnesc trebuie sa aiba de asemenea o orientare (un unghi) favorabila formarii produsilor de reactie, adica redistribuirii legaturilor chimice.
Fig. 1 Ciocniri intre molecule:
a - ciocniri neeficace; b - ciocnirii eficace; c - structura moleculei obtinute.
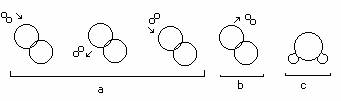
Conform teoriei complexului activat, pentru a avea loc o reactie chimica, particulele reactante trebuie sa se ciocneasca, dar nu toate ciocnirile sunt eficace, ci numai acelea care satisfac conditia geometrica si cea energetica.
Daca energia particulelor care se ciocnesc depaseste o anumita valoare E - denumita energie de activare - reactia se produce, iar particulele care satisfac aceasta conditie sunt activate. Prin ciocnirea dintre acestea se formeaza o asociatie temporara bogata in energie, denumita complex activat.
Particulele care se ciocnesc au o anumita energie cinetica. Prin ciocnire o parte din energia cinetica se transforma in energie potentiala a complexului activat. Daca moleculele care se ciocnesc au o energie scazuta, legaturile existente nu pot fi rupte, dupa ciocnire particulele se separa fara o modificare a structurii acestora. In cazul in care particulele care se ciocnesc au o energie suficient de mare, pentru a se produce ruperea legaturilor existente si formarea altora noi, au loc reactii chimice. Aceasta energie minima a particulelor, necesara pentru formarea complexului activat, se numeste energie de activare.
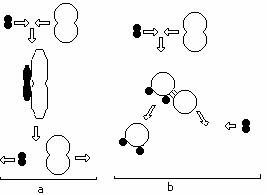
activat:
a - reactia chimica nu are loc;
b - reactia a avut loc.

Se consideram cazul general al unei reactii de tipul:
 Pentru
toate reactiile chimice, exoterme si endoterme, complexul activat
este starea cu energia cea mai ridicata, atat fata de
reactanti cat si fata de produsi. Prezentarea
grafica a variatiei energiei potentiale a sistemului in functie
de o coordonata de reactie:
Pentru
toate reactiile chimice, exoterme si endoterme, complexul activat
este starea cu energia cea mai ridicata, atat fata de
reactanti cat si fata de produsi. Prezentarea
grafica a variatiei energiei potentiale a sistemului in functie
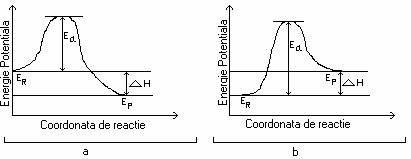
de o coordonata de reactie: Fig. 3 Variatia energiei potentiale in reactiile chimice:
a - DH = EP - ER (reactie exoterma)
b -- DH = EP -Ea (reactie endoterma)
Moleculele reactante au o energie potentiala medie ER. Prin ciocnirea moleculelor energia potentiala a sistemului creste, intrucat trebuie sa se efectueze un lucru pentru a invinge repulsiile electrostatice ale norilor electronici ai particulelor reactante, deci o parte din energia cinetica se transforma in energie potentiala. Moleculele activate formeaza complexul activat cu energia E*. Fiind instabil, complexul activat se descompune in produsi de reactie cu energie potentiala medie EP mai scazuta.
Energia de activare a procesului este egala cu diferenta dintre energia complexului E* si energia reactantilor: Ea = E* - ER. Caldura de reactie DH, atat pentru reactiile exoterme cat si pentru reactiile endoterme este independenta de viteza de reactie si de energia de activare.
III. VITEZA DE REACTIE
Observatiile experimentale arata ca transformarea unor reactantii in produsi corespunzatori de reactie necesita un timp indelungat.
Pentru a pune in evidenta desfasurarea unei reactii chimice in timp este suficient sa masuram concentratia unui reactant sau a unui produs in diferite momente.
Se poate aprecia viteza de transformare a diferitilor reactanti masurand variatia concentratiei acestora in unitatea de timp. Aceasta marime care indica variatia concentratiei reactantilor sau produsilor in unitatea de timp se numeste viteza de reactie.
Viteza este totdeauna o viteza pozitiva. Conventional se atribuie vitezei de reactie semnul plus cand se refera la cresterea concentratiei produsilor si semnul minus, cand se refera la scaderea concentratiei reactantilor:
![]()
Dc - variatia concentratiei molare
Dt - variatia timpului
Viteza de reactie se exprima in mol/L*s sau mol/L*min.
In general, pentru o reactie de tipul:
aA + bB T cC + dD
se verifica relatia:
![]()
IV. Factorii care influenteaza
viteza de reactie
IV.1. influenta concentratiei reactantilor asupra vitezei de reactie
In cadrul experimentelor pe care le-am efectuat am observat ca viteza de reactie depinde de concentratia reactantilor. In general, cand se mareste concentratia acestora, viteza de reactie creste.
Conform teoriei ciocnirilor, viteza unei reactii este data de numarul ciocnirilor eficace ce au avut loc in unitatea de timp. Prin marirea coeficientilor unuia dintre reactanti sau a ambilor numarul particulelor din unitatea de volum creste, deci probabilitatea ca acestea sa se ciocneasca in unitatea de timp este mai mare. In consecinta viteza de reactie creste cu marirea concentratiei.
Timpul de reactie este considerat timpul scurs de la amestecarea reactantilor pana la aparitia primelor particule de produsi.
IV.1. 1. Ordinul de reactie. Molecularitate.
Exemplu reactia oxidului de carbon cu dioxidul de azot:
CO(g) + NO2(g) CO2 + NO(g)
Sa consideram o reactie de tipul:
mA + nB T Produsi
in care a si b sunt coeficienti stoechiometrici ai reactantilor A si B. Pentru acest tip de reactie viteza va depinde de concentratiile lui A si B la anumite puteri si de alti factori. Actiunea tuturor acestor factori se inglobeaza intr-o constanta k - denumita constanta de viteza iar expresia vitezei de reactie se scrie:
v = k [A]m [B]n
[A] si [B] reprezinta concentratiile molare ale reactantilor; m, n sunt coeficientii stoechiometrici sau ordine partiale de reactie. Ordinul total de reactie se obtine insumand ordinele partiale
nA + nB = n
Ordinele partiale de reactie difera uneori de coeficientii stoechiometrici a respectiv b. Suma coeficientilor a + b = m reprezinta molecularitatea reactiei.
IV.1. 2. Clasificarea reactilor chimice din punct de vadere cinetic
Din punct de vedere cinetic reactiile se pot clasifica dupa ordin in reactii de ordinul 1, de ordinul 2 etc. de asemenea s-au pus in evidenta si ordine de reactie fractionare. Reactiile se pot clasifica si in functie de molecularitate in reactii monomoleculare, dimoleculare etc. Ordinul de reactie coincide cu molecularitatea numai in cazul reactiilor simple, care decurg intr-o singura etapa.
A. Reactii de ordinul I
Exemplu descompunerea bromurii de etil:
C2H5Br C2H4 + HBr
Expresia generala a unei reactii de acest tip este:
A Produsi
pentru acest tip ecuatia de viteza unde k1 este constanta de viteza pentru reactiile de ordinul I are forma:
v = k1[A]
Reactiile de ordinul I se caracterizeaza prin timpul de injumatatire t1/2, marime definita ca timpul in care a reactionat jumatate din cantitatea initiala de substanta. Pentru reactiile de ordinul I aceasta este o constanta specifica fiecarei reactii, caracteristica dependenta numai de:
![]()
B. Reactii de ordinul II
Exemplu formarea acetatului de etil:
CH3COOH + C2H5OH CH3COOC2H5 +H2O
Expresia generala a unei reactii de acest tip este:
A +B Produsi
pentru acest tip ecuatia de viteza unde k2 este constante de viteza pentru reactiile de ordinul II are forma:
v = k2 [A] [B]
IV.1. 3. Mecanisme de reactie
O reactie chimica poate avea loc intr-o singura etapa, sau in mai multe etape. Suma ecuatiilor etapelor intermediare reprezinta ecuatia stoechiometrica globala. Astfel, unei reactii care are loc in urma unui proces care se desfasoara in doua etape de forma:
A + A C C + B D
ii corespunde urmatoarea ecuatie stoechiometrica:
2A + B D
Elucidarea mecanismului unei reactii prin punerea in evidenta a etapelor intermediare si a speciilor active (C in exemplu) constituie una dintre problemele cele mai dificile cu care este confruntata cinetica chimica.
Daca una din etape este mai lenta (in cazul exemplificat 1) ea este determinata de viteza, deci ea controleaza viteza de reactie.
IV.2. influenta temperaturii asupra vitezei de reactie
In general viteza reactiilor chimice se modifica considerabil sub actiunea temperaturii. Marea majoritate a reactiilor chimice au loc cu o viteza mai mare la temperaturi mai ridicate. Cresterea temperaturii produce o crestere a vitezei particulelor reactante si a energiei cinetice. Numarul ciocnirilor eficace dintre particulele care ating energia de activare Ea creste in unitatea de timp, deci viteza procesului creste de asemenea.
Influenta temperaturii asupra vitezei de reactie apare in constanta de viteza K. Dependenta constantei de viteza de temperatura este data de ecuatia lui Arrhenius:
K = A eEa/RT
unde Ea este energia de activare, T - temperatura absoluta, R - constanta gazelor ideale, iar A este o constanta caracteristica fiecarei reactii (A = r Z; Z este numarul de ciocniri pe care moleculele le executa intr-o secunda si r este fractiunea de ciocniri eficace).
IV.3. influenta suprafetei de contact asupra
vitezei de reactie
Suprafata de contact este un factor care influenteaza considerabil viteza reactiilor chimice, in sistem eterogen.
In solutie reactantii se amesteca la nivel molecular iar reactia decurge cu viteza mare, deoarece probabilitatea ciocnirii a doua particule este foarte mare in masa fluidului. In amestecul pulverulent reactia nu are loc in intreaga masa a sistemului, ci este localizata la nivelul punctelor in care granulele substantelor vin in contact. In cazul cristalelor numarul punctelor de contact este si mai mic.
IV.4. influenta catalizatorilor asupra
vitezei de reactie
IV.4. 1. Clasificarea reactiilor catalitice
Catalizatorii sunt substante care modifica viteza reactiilor chimice, actionand asupra mecanismului lor. Acestia participa la reactia chimica, dar se regasesc cantitativ la sfarsitul ciclului de reactie. Sistemul reactanti-catalizatori poate fi format dintr-o singura faza (portiune omogena dintr-un sistem, separata de restul sistemului prin suprafete de separare) sau din faze diferite (solid-gaz, solid-lichid, etc.).
Reactiile in care catalizatorul si reactantii apartin aceleiasi faze se incadreaza in cataliza omogena, iar cele in care catalizatorul constituie o faza independenta in cataliza eterogena.
IV.4. 2. proprietatile generale ale catalizatorilor
Orice catalizator este caracterizat prin activitate catalitica. Aceasta se poate masura ca viteza de reactie exprimata prin numarul de molecule ce reactioneaza in unitatea de timp pe unitatea de spatiu de reactie.
Activitatea catalizatorilor scade treptat in timp - se dezactiveaza. De aceea din timp in timp catalizatorii trebuie reactivati.
O clasa de substante denumite promotori, in absenta catalizatorilor, nu modifica viteza de reactie dar impreuna cu catalizatorii maresc considerabil activitatea catalizatorilor. Anumite substante au capacitatea de a reduce sau, in unele cazuri de a anula activitatea catalizatorilor. Aceste substante se numesc otravuri.
O alta caracteristica importanta a catalizatorilor este selectivitatea, manifestata prin aceea ca ei favorizeaza numai una din mai multe reactii posibile.
IV.4. 3. Mecanismul reactiilor catalitice
Experimental s-a constatat ca viteza reactiilor in care intervin catalizatorii este diferita de viteza acelorasi reactii in absenta catalizatorilor. Aceasta se datoreaza modificarii mecanismului reactiilor si scaderii, in general, a energiei de activare a procesului.
Din punct de vedere energetic procesele care au loc in reactiile catalitice, referindu-ne la o reactie de tipul A + B C cu energia de activare Ea , se constata ca in absenta catalizatorului energia de activare este mai mare decat in prezenta catalizatorului ceea ce conduce la o marire a vitezei de reactie. Catalizatorul nu modifica caldura de reactie.
Bibliografie:
Manual Chimie cls. XII - editura didactica
Manual Chimie cls. X - Editura Humanitas
Caiet Cls. X
Microsoft Encarta 2000