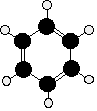
 Kekulé a fost primul care a
sugerat o structura sensibila pentru benzen. Carbonii sunt aranjati in forma de
hexagon, si el a sugerat alternanta legaturilor simple si duble intre ei.
Fiecare atom de carbon are un atom de hidrogen atasat.
Kekulé a fost primul care a
sugerat o structura sensibila pentru benzen. Carbonii sunt aranjati in forma de
hexagon, si el a sugerat alternanta legaturilor simple si duble intre ei.
Fiecare atom de carbon are un atom de hidrogen atasat.
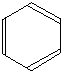 Aceasta diagrama e deseori
simplificata, nescriind nici un atom de H sau de C.
Aceasta diagrama e deseori
simplificata, nescriind nici un atom de H sau de C.
In acest tip de diagrama, exista cate un atom de C la fiecare colt. Trebuie numarate legaturile ramase la fiecare carbon pentru a ne da seama cati atomi de H sunt atasati acelui atom de carbon.
In acest caz, fiecare carbon are trei legaturi cu atomii vecini de acelasi fel. Deoarece atomii de carbon sunt tetra-valenti, fiecare dintre ei are atasat cate un atom de hidrogen.
Cu toate ca structura Kekulé a fost o incercare reusita la vremea ei, sunt cateva probleme destul de serioase in legatura cu ea.
a. Probleme cu reactiile chimice
Din cauza celor trei legaturi duble, ne-am astepta ca benzenul sa dea reactii asemanatoare etenei.
Etena sufera reactii de aditie in care legatura dubla dintre doi atomi de carbon se rupe, transformandu-se in legatura simpla, electronii ramasi fiind folositi pentru legarea cu atomii aditionali.
In cazul benzenului, acest lucru se petrece foarte rar. In schimb, acesta sufera reactii de substitutie, in care unul din atomii de hidrogen este inlocuit de alt atom.
b. Probleme cu forma
Benzenul este o molecula plana, si structura Kekulé nu contrazice acest lucru. Problema este ca legaturile simple C-C si cele duble C=C au lungimi diferite:
ð Legatura C-C are o lungime de 0.154 nm
ð Legatura C=C are o lungime de 0.134 nm
Ar insemna ca hexagonul ar fi neregulat daca ar avea structura Kekulé, cu laturi mai scurte si mai lungi alternand. La benzenul real toate legaturile sunt exact la fel - cu o lungime intre valorile celor de C-C si C=C , de 0.139 nm. Benzenul real este o molecula cu forma unui hexagon perfect regulat.
c. Probleme cu stabilitatea benzenului
Benzenul real este mult mai stabil decat ne-ar arata formula Kekulé. De fiecare data cand trebuie sa facem un calcul termochimic bazat pe structura Kekulé, obtinem un rezultat ce difera de realitate cam cu 150 kJ mol-1. Acest lucru e cel mai usor aratat folosind variatiile de entalpie la hidrogenare.
Reactia de hidrogenare este o reactie de aditie a hidrogenului. Daca, de exemplu, hidrogenam etena, obtinem etanul:
H2C=CH2 + H2 -> CH3-CH3
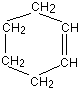 Pentru a face o comparatie cu benzenul (structura ciclica), il vom
compara cu ciclohexena. Ciclohexena, C6H10,
este o structura ciclica de 6 atomi de carboni, continand doar o singura
legatura dubla C=C.
Pentru a face o comparatie cu benzenul (structura ciclica), il vom
compara cu ciclohexena. Ciclohexena, C6H10,
este o structura ciclica de 6 atomi de carboni, continand doar o singura
legatura dubla C=C.
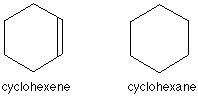
Cand aditionam hidrogen la ciclohexena obtinem ciclohexanul, C6H12.
Structurile ciclohexenei si ciclohexanului sunt de obicei simplificate in acelasi mod ca si structura Kekulé - lasand la o parte toti atomii de carbon si hidrogen.
Ecuatia aditiei poate fi scrisa, deci, astfel:
![]()
Variatia entalpiei in aceasta reactie este de -120 kJ mol-1. Cu alte cuvinte, cand un mol de ciclohexena reactioneaza, 120 kJ de energie este degajata.
De unde rezulta aceasta energie? Cand reactia are loc, ruperea legaturilor (C=C si H-H) consuma energie. Alte legaturi trebuie sa fie facute, ceea ce degaja energie.
Deoarece legaturile facute sunt mai puternice decat cele rupte, este degajata mai multa energie decat este absorbita la ruperea legaturilor originale, si de aceea are loc o degajare de energie, sub forma de caldura, spre exterior.
Daca ciclul ar fi avut doua legaturi duble initial (1,3-ciclohexadiena), exact de doua ori mai multe legaturi ar fi trebuit rupte si exact de doua ori mai multe formate. Cu alte cuvinte, ne-am astepta ca variatia de entalpie la hidrogenarea 1,3-ciclohexadienei sa fie exact de doua ori cea a ciclohexenei, adica -240 kJ mol-1.
![]()
De fapt, variatia de entalpie este de -232 kJ mol-1 - valoare ce nu este departe de predictiile noastre, neingrijorandu-ne, deoarece calculele in termochimie introduc unele erori de acest ordin de marime.
Aplicand acelasi principiu structurii Kekulé a benzenului (adica 1,3,5-ciclohexatriena), ne-am astepta la o variatie a intropiei de -360 kJ mol-1, din aceleasi argumente ca cele de mai sus.
![]()
De fapt, in realitate se obtine o valoare de -208 kJ mol-1 care nu este deloc prin preajma valorii prezise de teorie.
Acest lucru este mai usor de observat pe o diagrama a entropiei. Observam ca in fiecare caz reactia are loc cu degajare de energie, si in fiecare caz produsul de reactie este acelasi - ciclohexanul. Acest lucru inseamna ca toate reactiile ajung in final la acelasi punct.
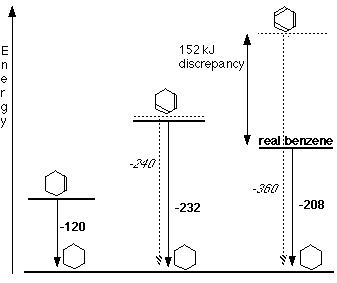
Liniile ingrosate, sagetile groase si numerele bold reprezinta variatiile reale. Variatiile prezise sunt schematic aratate prin linii si sageti punctate.
Cel mai important lucru de observat este ca benzenul este mult mai jos pe diargrama decat predictiile formulei Kekulé. Cu cat o substanta se afla mai jos pe aceasta diagrama, cu atat mai stabila este.
Aceasta inseamna ca benzenul real este cam cu 150 kJ mol-1 mai stabil decat o arata formula Kekulé. Aceasta crestere a stabilitatii benzenului este cunoscuta ca energia de delocalizare sau energia de rezonanta a benzenului. Primul termen este mai uzitat in literatura de specialitate.
Dar de ce este benzenul mult mai stabil decat ne sugereaza formula Kekulé?
Benzenul este alcatuit din atomi de hidrogen (1s1) si atomi de carbon (1s22s22px12py1).
Fiecare atom de carbon trebuie sa se lege de alti trei atomi( un H si doi C) si n-are destui electroni pe orbitalul 2p pentru a satisface numarul de legaturi, deci trebuie sa treaca unul din electronii 2s2 in orbitalul p, formand astfel structura cuantica de mai jos, cu toti cei 3 electroni ai orbitalului 2p avand acelasi spin. Acelasi lucru se intampla intotdeauna cand carbonul formeaza legaturi.
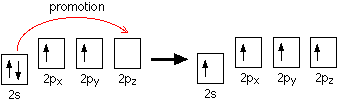
Deoarece carbonul se leaga doar cu trei alti atomi, cand atomii de carbon hibridizeaza orbitalii extremi inaintea formarii legaturilor, este suficient sa hibridizeze doar trei din orbitali, nu toti patru. Pentru legaturi folosesc doar doi din cei trei electroni 2p si pe cel 2s ramas, unul din cei trei electroni 2p ramanand neschimbat.
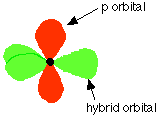 Orbitalii astfel formati se
numesc hibrizi sp2 ,
deoarece sunt alcatuiti dintr-un electron s si doi electroni p, dupa
rearanjare. Orbitalii hibrizi sp2 se aranjeaza la maxima departare
unul de celalalt, adica la 120° unul de celalalt, intr-un plan. Orbitalul p
este perpendicular pe planul celor trei.
Orbitalii astfel formati se
numesc hibrizi sp2 ,
deoarece sunt alcatuiti dintr-un electron s si doi electroni p, dupa
rearanjare. Orbitalii hibrizi sp2 se aranjeaza la maxima departare
unul de celalalt, adica la 120° unul de celalalt, intr-un plan. Orbitalul p
este perpendicular pe planul celor trei.
Fiecare atom de carbon arata acum asemenea diagramei din dreapta. Exact astfel se intampla si la etena.
La benzen, diferenta este ca fiecare atom de carbon se uneste cu doi atomi similari de carbon, nu doar cu unul. Fiecare atom de carbon foloseste hibrizii sp2 pentru a forma legaturi sigma cu alti doi atomi de carbon si un atom de hidrogen. Urmatoarea schema sugereaza legaturile sigma formate, lasand pentru moment orbitalii p nelegati.
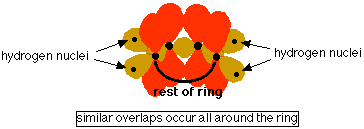
Doar o parte a ciclului este schitata deoarece desenul se complica daca se incearca schitarea mai multora.
De observat ca electronul p de la fiecare carbon se suprapune cu cei din ambele parti ale sale. Aceste suprapuneri latererale produc un sistem de legaturi pi, ce sunt situate pe tot inelul de atomi de carbon. Deoarece electronii nu mai sunt in preajma a doar doi atomi de carbon, ci sunt imprastiati pe tot inelul de carboni, electronii sunt numiti delocalizati. Cei sase electroni delocalizati intra in trei orbitali moleculari - cate doi in fiecare.
In consens cu marea majoritate a descrierilor legaturilor in benzen, vom schita unul din acesti orbitali moleculari pentru simplitate.
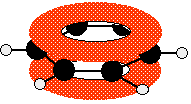 In diagrama, legaturile sigma
sunt sugerate prin linii simple pentru a nu crea confuzii. Cele doua inele de
deasupra si dedesubtul planului molecular reprezinta un orbital molecular. Cei doi electroni delocalizati ai acestui
orbital pot fi gasiti oriunde in aceste doua inele. Cei alti patru electroni se
pot gasi in alti doi orbitali moleculari similari (dar nu identici).
In diagrama, legaturile sigma
sunt sugerate prin linii simple pentru a nu crea confuzii. Cele doua inele de
deasupra si dedesubtul planului molecular reprezinta un orbital molecular. Cei doi electroni delocalizati ai acestui
orbital pot fi gasiti oriunde in aceste doua inele. Cei alti patru electroni se
pot gasi in alti doi orbitali moleculari similari (dar nu identici).
a. Forma benzenului
Aceasta este explicata cu usurinta. Benzenul este un hexagon regulat deoarece toate legaturile sunt identice. Delocalizarea electronilor inseamna ca nu exista legaturi duble sau simple.
b. Stabilitatea energetica a benzenului.
Aceasta e pusa pe seama delocalizarii. Ca un principiu general, cu cat electronii sunt mai imprastiati - in alte cuvinte, cu cat sunt mai delocalizati - cu atat molecula devine mai stabila. Stabilitatea in plus a benzenului este cunoscuta sub numele de "energie de delocalizare".
c. De ce moleculele de benzen nu sunt predispuse la reactii de aditie?
Cu electronii delocalizati, benzenul este cam cu 150 kJ mol-1 mai stabil. Daca am adauga alti atomi la ciclul benzenului ar trebui sa folosim din electronii delocalizati pentru a forma legaturi. Acest lucru ar scadea deranja delocalizarea, sistemul devenind mai putin stabil.
Deoarece o cantitate de 150 kJ pentru un mol de benzen ar trebui sa fie furnizata pentru a rupe delocalizarea, acest lucru este foarte putin probabil.
d. Simbolul pentru benzen
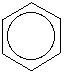 Cu toate ca se intalneste destul
de des si simbolul ce sugereaza structura Kekulé, vom folosi si simbolul din
dreapta, conform structurii orbitale.
Cu toate ca se intalneste destul
de des si simbolul ce sugereaza structura Kekulé, vom folosi si simbolul din
dreapta, conform structurii orbitale.
Hexagonul sugereaza inelul de sase atomi de carbon, fiecare avand cate un hidrogen atasat. In acest caz numararea legaturilor nu da numarul de hidrogeni pentru fiecare atom de carboni.
Cercul reprezinta electronii delocalizati. Este esential sa includem si cercul, daca nu-l desenam vom reprezenta ciclohexanul, nu benzenul.
Bram Stroker
bram_lex@hotmail.com