UNIVERSITATEA 'POLITEHNICA' DIN BUCURESTI
CATEDRA DE FIZICÅ
LABORATORUL DE FIZIC| ATOMIC| {I FIZICA CORPULUI SOLID
BN - 031 B
DETERMINAREA CONSTANTEI RYDBERG
DETERMINAREA CONSTANTEI RYDBERG
1. Scopul lucrarii
Determinarea constantei implicata in seriile spectrale ale atomilor hidrogenoizi
2. Teoria lucrarii
Atomii fiecarui element emit, atunci cand sunt excitati (de exemplu intr-o descarcare in gaz), un spectru optic caracteristic de radiatii, dupa care poate fi identificat acel element. Spectrele elementelor chimice sunt cu atat mai complicate, cu cat numarul lor de ordine Z este mai mare. Spectrele optice ale atomilor sunt datorate electronilor optici, adica electronilor ce se gasesc pe orbita periferica.
Spectroscopistii experimentali au stabilit ca toate liniile din diferitele serii spectrale ale atomului de hidrogen pot fi descrise printr-o relatie generala care da lungimea de unda a liniilor spectrale:
![]() (1)
(1)
In aceasta relatie n
si m sunt numere intregi, T(m)
si T(n)
sunt termeni spectrali, iar ![]() este
este
Explicarea liniilor spectrale ale atomului de hidrogen a constituit o verificare de succes a teoriei atomului de hidrogen data de Niels Bohr. Bohr afirma ca nu exista decat anumite orbite permise pentru electron, corespunzatoare unor stari stationare.
El emite urmatoarele postulate:
I. Atomul se poate afla intr-un sir
discret de stari stationare, determinate de sirul discret ![]() ale energiei totale. In
aceste stari atomul nici nu emite, nici nu absoarbe energia.
ale energiei totale. In
aceste stari atomul nici nu emite, nici nu absoarbe energia.
II. Energia atomului poate varia
discontinuu, prin trecerea de la o stare stationara de energie totala ![]() la alta stare stationara
de energie totala
la alta stare stationara
de energie totala ![]() . Frecventa fotonului absorbit sau emis este data de relatia:
. Frecventa fotonului absorbit sau emis este data de relatia:
![]() (2)
(2)
procesul de absorbtie avand loc in cazul in care electronul trece de pe o orbita mai apropiata de nucleu pe una mai departata, iar emisia atunci cand parcurge drumul invers.
Specificarea orbitelor permise se obtine
prin introducerea conditiei de cuantificare enuntata de Bohr care precizeaza ca
marimea momentului cinetic al electronului pe orbitele permise trebuie sa fie
egala cu un numar intreg de ![]() :
:
![]() (3)
(3)
unde ![]() si n =
1, 2, 3,.
si n =
1, 2, 3,.
Energia totala En pe orbita n este cuantificata:
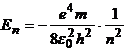 (4)
(4)
unde m
este masa electronului, e este sarcina electronului, ![]() este permitivitatea
electrica a vidului, h este
este permitivitatea
electrica a vidului, h este
In mecanica cuantica energia electronului din atomul de hidrogen, expresia (4), se afla prin integrarea ecuatiei Schr dinger, fara a se mai introduce conditia (3).
Energia totala a electronului este negativa, ceea ce exprima faptul ca electronul se afla legat in campul electromagnetic al nucleului.
Folosind relatiile (2) si (4) se obtine:
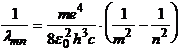 (5)
(5)
care comparata cu (1), rezulta:
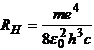 , (6)
, (6)
expresie obtinuta in cazul modelului in care s-a considerat protonul imobil.
Din (2) pot fi gasite toate lungimile de unda ale liniilor diferitelor serii spectrale ale hidrogenului. O serie spectrala reprezinta totalitatea liniilor spectrale care au un nivel energetic de baza comun (fig.1), nivelul pe care se introduc electronii.
Astfel exista seria Lyman la care
nivelul energetic comun este corespunzator lui m=1 (in relatia
(5)), iar ![]() si are liniile in
domeniul ultraviolet; seria Balmer (vizibil) la care m=2 si n=3, 4, 5; seria
Paschen la care m=3 si n=4, 5, iar liniile spectrale au lungimile de unda
corespunzatoare radiatiilor din infrarosu etc.
si are liniile in
domeniul ultraviolet; seria Balmer (vizibil) la care m=2 si n=3, 4, 5; seria
Paschen la care m=3 si n=4, 5, iar liniile spectrale au lungimile de unda
corespunzatoare radiatiilor din infrarosu etc.
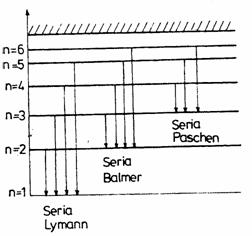
Fig. 1
In aceasta lucrare se va studia seria
spectrala Balmer, determinandu-se lungimile de unda pentru liniile ![]() prezentate in figura
2.
prezentate in figura
2.
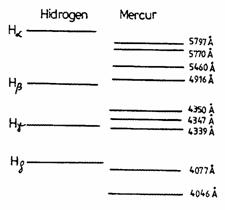
Fig. 2
In cazul seriei Balmer, relatia (1) devine:
![]()
de unde rezulta
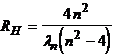 (8)
(8)
3. Dispozitivul experimental
Spectrul hidrogenului in vizibil este inregistrat pe o placa fotografica (spectrograma) care se afla montata intre doua placute de plexiglas. Pe aceeasi placa fotografica, alaturi de spectrul hidrogenului, apare si spectrul mercurului, ca spectru de comparatie, fiind inregistrat la acelasi spectroscop si in conditii identice.
Spectrul mercurului prezinta un numar
mai mic de linii, configuratia lor putand fi recunoscuta conform figurii 2, pe
care sunt indicate si lungimile de unda corespunzatoare fiecarei linii
spectrale. Spectrul hidrogenului contine mai multe linii, deoarece pe un film
au fost inregistrate si linii ale hidrogenului molecular, dar liniile hidrogenului
atomic ![]() care ne intereseaza si a caror lungime de unda o vom
determina, au fost insemnate la capete cu cerneala.
care ne intereseaza si a caror lungime de unda o vom
determina, au fost insemnate la capete cu cerneala.
Spectrul mercurului prezinta un numar
de 17 linii, configuratia lor putand fi recunoscuta conform fig.2. Pentru 9
linii ale mercurului sunt date lungimile de unda corespunzatoare. Liniile
hidrogenului atomic apartinand seriei Balmer (![]() ) a caror lungime de unda o vom determina apar in figura 2 in
pozitiile lor relative fata de liniile spectrului mercurului.
) a caror lungime de unda o vom determina apar in figura 2 in
pozitiile lor relative fata de liniile spectrului mercurului.
Studierea spectrogramei se face cu un microscop. Masuta microscopului poate fi deplasata in plan orizontal, pe doua directii perpendiculare, cu ajutorul a doua suruburi. Deplasarea in lungul spectrului permite masurarea pozitiei unei linii spectrale pe o rigla gradata in mm, si un vernier cu precizie de 0,1 mm. Pentru fixarea pozitiei liniei dorite, ocularul microscopului este prevazut cu un fir reticular.
Pentru efectuarea lucrarii sunt necesare: spectrograma cu spectrul hidrogenului atomic vizibil (seria Balmer), cu spectrul mercurului si un microscop.
4. Modul de lucru
Privind prin ocular, se potriveste oglinda microscopului pentru a avea o buna iluminare. Pentru a nu se sparge spectrograma, pozitia initiala a microscopului trebuie sa fie cu obiectivul lipit de spectrograma ca apoi sa se ridice treptat tubul microscopului, pana cand liniile spectrale apar clare. Se verifica paralelismul intre liniile spectrale si firul reticular, asezarea paralela a firului reticular facandu-se prin rotirea ocularului.
Se identifica spectrul mercurului si
al hidrogenului privind intai spectrograma cu ochiul liber si apoi la
microscop. Se citesc pe rigla gradata (prin suprapunerea firului reticular pe
fiecare linie) pozitiile ![]() ale celor 9 linii ale
mercurului, pentru fiecare sunt date lungimile de unda. Se citesc, de asemenea,
pe rigla gradata pozitiile
ale celor 9 linii ale
mercurului, pentru fiecare sunt date lungimile de unda. Se citesc, de asemenea,
pe rigla gradata pozitiile ![]() ale celor 4 linii din
seria hidrogenului (
ale celor 4 linii din
seria hidrogenului (![]() ). Se traseaza pe hartie milimetrica curba de etalonare
). Se traseaza pe hartie milimetrica curba de etalonare ![]() pentru mercur.
pentru mercur.
Avand pozitiile ![]() ale celor 4 linii ale
hidrogenului se scot din curba de etalonare lungimile de unda ale liniilor
ale celor 4 linii ale
hidrogenului se scot din curba de etalonare lungimile de unda ale liniilor ![]() necesare pentru
calcularea constantei lui Rydberg.
necesare pentru
calcularea constantei lui Rydberg.
5. Prelucrarea datelor experimentale
Datele
masurate pentru liniile ![]() se trec intr-un tabel
de forma (a).
se trec intr-un tabel
de forma (a).
Se calculeaza
Tabel a
|
Linia |
x (mm) |
l |
n |
RH |
|
Ha |
|
|
|
|
Se calculeaza valoarea medie 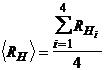 .
.
6. Intrebari
1. Ce este o linie spectrala?
2. Ce este un termen spectral?
3.Ce postulate au stat la baza stabilirii de catre Bohr a formulei energiei corespunzatoare electronilor in atomul de hidrogen?