UNIVERSITATEA "POLITEHNICA" DIN BUCURE{TI
CATEDRA DE FIZIC|
DETERMINAREA COEFICIENTULUI ADIABATIC
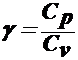 AL AERULUI UTILIZAND
METODA
AL AERULUI UTILIZAND
METODA
CLÉMENT-DESORMES
DETERMINAREA COEFICIENTULUI ADIABATIC ![]()
AL AERULUI UTILIZAND METODA CLÉMENT-DESORMES
1.Scopul lucrarii
Lucrarea
are drept scop determinarea coeficientului adiabatic ![]() al aerului, presupus
gaz ideal si supus unor transormari termodinamice simple.
al aerului, presupus
gaz ideal si supus unor transormari termodinamice simple.
2.Teoria lucrarii
Capacitatea calorica molara a unei substante reprezinta cantitatea de caldura schimbata cu exteriorul de un mol din acea substanta pentru a-si varia temperatura cu un grad
![]() (1)
(1)
Daca schimbul de caldura `ntre
substanta si mediul exterior are loc la presiunea ![]() , respectiv
, respectiv ![]() , iar raportul
, iar raportul
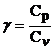 (2)
(2)
se numeste coeficient adiabatic.
Diferenta `ntre cele doua capacitati calorice molare depinde de substanta considerata,iar pentru gazele ideale:
![]() (3)
(3)
(relatia lui Robert-Mayer)
Tot `n cazul gazelor ideale,cele doua capacitati calorice molare depind de numarul i de grade de libertate a particulelor din care e compus gazul:
![]()
(4)
![]()
unde R
este
An acest caz
![]() (5)
(5)
Pentru gazele ideale monoatomice i=3,pentru cele cu molecule liniare i = 5, etc.
An cazul gazelor reale, expresia coeficientului g e mai complicata si e legata de ecuatia termica de stare a gazului respectiv.
Determinarea coeficientului adiabatic este foarte importanta deoarece intervine `n probleme legate de propagarea sunetului `n gaze, de curgerea gazelor la viteze supersonice, etc.
Pentru gazele ideale,acest coeficient intervine `n descrierea proceselor adiabatice, conform ecuatiei lui Poisson:
![]() (6)
(6)
3.Metoda lucrarii
Exista mai multe metode de determinare a raportului g: metoda calorimetrica de determinare
a
capacitatilor calorice, metoda acustica-bazata pe dependenta de ![]() vitezei sunetului `n
gaze,etc.
vitezei sunetului `n
gaze,etc.
Pentru gazele ideale,vom descrie metoda propusa de Clément si Desormes.
Sa presupunem ca avem un recipient
cu aer -presupus gaz ideal- la o presiune ![]() =(H-h)rg unde rgH e presiunea atmosferica masurata cu un
manometru cu lichid de densitate r, iar
rgh e diferenta dintre presiunea
atmosferica si cea din recipient, masurata cu acelasi manometru.
=(H-h)rg unde rgH e presiunea atmosferica masurata cu un
manometru cu lichid de densitate r, iar
rgh e diferenta dintre presiunea
atmosferica si cea din recipient, masurata cu acelasi manometru.
Gazul ocupa volumul ![]() al recipientului si are temperatura
al recipientului si are temperatura ![]() a mediului ambiant.
a mediului ambiant.
Daca acest gaz sufera o comprimare
adiabatica, `n urma careia volumul se micsoreaza, presiunea creste la ![]() , iar temperatura creste si ea la
, iar temperatura creste si ea la ![]() ,ecuatia Poisson care descrie procesul se va scrie:
,ecuatia Poisson care descrie procesul se va scrie:
![]() (7)
(7)
Anlocuind valorile presiunilor ![]()
![]() , ec.(7) devine:
, ec.(7) devine:
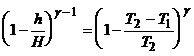 (8)
(8)
Daca h <<H,
variatia de temperatura ![]()
![]() e foarte mica:
e foarte mica: ![]() , deci fractiile din parantezele expresiei (8) vor fi foarte
mici; parantezele se pot dezvolta `n serie de puteri si se pot pastra numai
termenii de ordinul `ntai:
, deci fractiile din parantezele expresiei (8) vor fi foarte
mici; parantezele se pot dezvolta `n serie de puteri si se pot pastra numai
termenii de ordinul `ntai:
![]() (9)
(9)
de unde
H![]() (10)
(10)
Daca
`n continuare gazul sufera o racire izocora, de la ![]() la temperatura
la temperatura ![]() a camerei, presiunea lui va scadea la
a camerei, presiunea lui va scadea la ![]() , mai mica cu rgh'
decat presiunea atmosferica
, mai mica cu rgh'
decat presiunea atmosferica ![]() , astfel `ncat
, astfel `ncat
![]() (11)
(11)
sau
![]() (12)
(12)
de unde
![]() (13)
(13)
care `nlocuita `n (10) duce la
![]()
![]() (14)
(14)
Deci,
daca experimental se pot masura valorile h si h', se va putea
calcula coeficientul adiabatic ![]() .
.
4. Dispozitivul experimental (fig.1) consta dintr-un balon de sticla B cu capacitatea de aprox. 20 l , prevazut la partea superioara cu un robinet R cu deschidere mare,prin care comunica cu atmosfera si cu tubul lateral T care face legatura pe deoparte cu un manometru cu lichid M si pe de alta parte cu pompa aspiratoare P prin intermediul robinetului r si a tubului de cauciuc C.
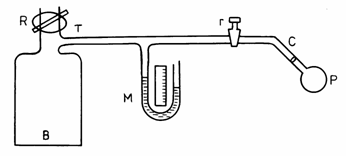
Fig.1
5. Modul de lucru
Cu robinetele R si r deschise, se verifica daca presiunea aerului din balon e aceeasi cu cea atmosferica (acelasi nivel al lichidului `n ambele brate ale manometrului)
Se `nchide robinetul R si cu robinetul r deschis,se aspira aer din balon cu pompa P,apoi se `nchide si robinetul r.
An
acest mod s-a realizat `n balon o anumita depresiune,masurata prin denivelarea
h(mm) a lichidului `n ramurile manometrului-care se citeste si se noteaza. Starea aerului din
balon `n acest moment s![]() volumul
volumul ![]() t este
starea initiala de echilibru.
t este
starea initiala de echilibru.
Se deschide cu atentie robinetul R, pentru un timp foarte scurt; `n acest mod, aerul atmosferic patrunde peste aerul din balon comprimandu-l.
Rotirea robinetului R nu trebuie sa se faca brusc; el va fi rotit cu viteza potrivita, ascultand suieratul provocat de intrarea aerului `n balon.
Robinetul R trebuie `nchis exact `n clipa cand se opreste suieratul, adica atunci cand s-a terminat patrunderea aerului `n balon, deci cand presiunea aerului din balon devine egala cu presiunea atmosferica (nivelele lichidului `n bratele manometrului vor fi egale).
Comprimarea brusca a aerului din balon are caracter adiabatic, deoarece pe durata scurta a acestui proces aerul din balon nu are timp sa schimbe caldurA cu peretii balonului.
Variatiile parametrilor de stare `n
timpul acestui proces adiabatic sunt foarte mici. Starea de echilibru a gazului
`n acest moment e descrisa de valorile:![]()
An continuare, aerul din balon `ncepe sa se raceasca pana ce se atinge din nou temperatura camerei; racirea se produce la volum aproximativ constant si e `nsotita de scaderea presiunii. Procesul de racire izocora `nceteaza atunci cand presiunea indicata de manometru se stabilizeaza, de aceasta data `ntre nivelele lichidului din ramurile manometrului exist`nd denivelarea h' (care se citeste si se noteaza).
Starea finala de echilibru a aerului
din balon va fi caracterizata de presiunea ![]() si temperatura
si temperatura ![]() a camerei.
a camerei.
Experienta se repeta de zece ori, schimb`nd de fiecare data depresiunea h
6. Indicatii pentru prelucrarea datelor experimentale
Cu valorile h si h'masurate de
fiecare data , se calculeaza ![]() dupa relatia (14).
dupa relatia (14).
Rezultatele se trec `ntr-un tabel de forma:
|
Nr.crt. |
h (mm) |
h'(mm) |
h-h'(mm) |
|
|
|
|
|
|
|
Referatul va cuprinde: descrierea
metodei experimentale utilizate, tabelul de rezultate, valoarea medie a lui ![]() , eroarea cu care s-a determinat (dispersia asupra mediei) si
sursele de erori.
, eroarea cu care s-a determinat (dispersia asupra mediei) si
sursele de erori.
Facultativ : exprimati presiunea atmosferica `n mm coloana de apa (H) si comparati valorile h si H.
Calculati raportul 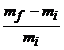 , unde
, unde ![]() este masa de gaze
existenta `n balon `n starea initiala si
este masa de gaze
existenta `n balon `n starea initiala si ![]() masa de gaz existenta
`n balon la sfarsitul experientei.
masa de gaz existenta
`n balon la sfarsitul experientei.
Apreciati daca se justifica ipoteza
masei de gaz
Apreciati avantajele folosirii manometrului cu apa fata de unul cu mercur.
Faceti aprecieri asupra cvasistationaritatii proceselor suferite de gazul din balon