Schülervortrag - Aldehyde und Ketone (2200 Wörter und viele Abbildungen)
Aldehyde:
Geschichte : - 1774 von Schale entdeckt
- Name - von Alkohol dehydrogenatum (nach Liebig)
Struktur : - Typ : R - CHO ( C = O - endständige Carbonylgruppe ; CHO - Aldehydgruppe)
- Bindungslänge : C=O : 122pm ; C O : 131pm
- Valenzbandmodell : - sp2 - hybridisiert
- C O - s - Bindung - aus je einem sp2 - Orbital von Kohlen - und Sauerstoff
- C O - p - Bindung - aus pz - Orbital von C und O
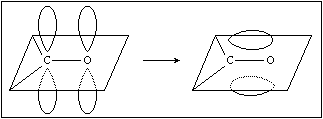
Bildung der C O - p - Bindung in der Carbonylgruppe durch Überlappung zweier 2p - Orbitale
- C=O - polar ; p - Elektronen - in Richtung O - verschoben O - d ; C - d
- R - aliphatischer, aromatischer oder heterocycloscher Rest
- Nomenklatur : - von entsprechenden Alkanen abgeleitet
- Vorsilbe Formyl oder Nachsilbe carbaldehyd ( vor allem bei mehrfachen und cyclischen
Aldehyden )
Bsp. : 1 - Metyldioxy - 1, 3, 5 - pentantricarbaldehyd : OHC CH2 CH2 CH CH2 CH CHO
CHO O O CH3
- wenn endständiges C-Atom zum Alkan, dann Vorsilbe Oxo und Nachsilbe al
- vor allem bei einfachen Aldehyden + deren Derivate )
Bsp. : Hexanal : H3C (CH2)4 CHO
- wichtigste Aldehyde - Trivialnamen : Formaldehyd - H CHO
Phtalaldehyd - OHC C6H4 CHO
Eigenschaften : - C1 - gasförmig (Raumtemperatur)
- C2 - C11 - brennbare, farblose, stark polarisierte Flüssigkeiten
- mit steigendem C - Gehalt - immer öliger
- Geruch - unangenehm angenehm (C8- C14- Duftstoffe)
- keine intermolekularen Wasserstoffbrückenbindungen Schmelz - und Siedepunkte - unter
denen der entsprechenden Alkohole (wegen zwischen Molekülen - keine Wasserstoffbrücken)
und über denen der Alkane (wegen Polarität der C=O)
- löslich in Alkoholen, Ethern und den meisten anderen org. Lösungsmitteln
- nur Form - und Acetaldehyd (C1, C2) - unbeschränkt in Wasser löslich, da durch die freien
Elektronenpaare am Sauerstoff der C=O - Wasserstoffbrückenbindungen möglich
- ab C6 - praktisch wasserunlöslich, da Polarität
- gesättigte Aldehyde - schleimhautreizend, in hohen Konzentrationen - leichte Narkotika
- ungesättigte Aldehyde - wesentlich toxischer
- leicht oxidierbar
- Additionsfähigkeit der Carbonylgruppe (C=O)
- Acidität der a - ständigen H - Atome
Nachweise : - Nylanders Reagenz (Lösung von 2g basischem Bismutnitrat und 4g Seignettsalz in
100g 10% - NaOH) schwarz
- Fehlingsche Lösung rot (ziegelrot) bei Erhitzung mit Aldehyden
- R CHO + 4 OH- + 2 Cu2+ Cu2O + R COOH + 2 H2O
- geht nicht bei Ketonen Unterscheidungsmöglichkeit
- Tollenzreagenz - ammoniakalische Silbernitratlösung - schwaches Erwärmen Reduzierung
der Silberionen zu Silber Silberspiegel oder in feinverteilter Form als schwarzer NS
(Oxidation der Aldehydes zur Carbonsäure)
- geht auch nicht bei Ketonen
ungesättigte Aldehyde : - stechend riechende Flüssigkeiten, mit höheren Gliedern - angenehmer Geruch
- vorherrschend - Additions - und Polymerisationsreaktionen
- Herstellung : - Oxidation von Olefinen
- Dehydratisierung von Aldolen
- wichtiger Vertreter : Acrolein (Acrylaldehyd : CH2=CH CHO)
Herstellung : - in der Natur nur geringe Vorkommen ( Acetaldehyd - Zwischenprodukt bei alkoholischer Gärung
höhere Aldehyde - Duftstoffe in ätherischen Pflanzenölen, ranziges Fett)

BASF - Verfahren : Dehydrieren höherer Celanese - Verfahren : Aldehydausbeute bei der
Alkohole zu höheren Aldehyden Oxidation von Butan
Oxosynthese : - wichtigstes Verfahren für C >3
- flüssige Olefine mit CO und H2
- R CH=CH2 + CO + H2 RCH2CH2 CHO
- auch verzweigte Aldehyde
Dehydrierung : - von primären Alkoholen (Ag-Kat., 600-700°C, 1bar)
- vor allem Formaldehyd, aber auch höhere Aldehyde
Einstufen - Verfahren von WACKER - HOECHST zur Herstellung von Acetaldehyd :
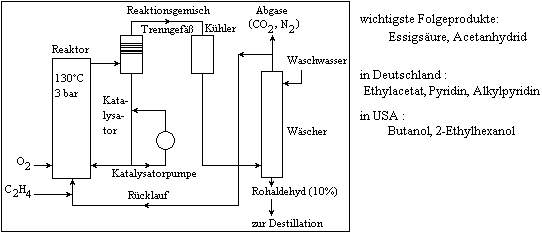
Oxidation : - von Butan-Propan-Gemischen in Gasphase (450°C, 7-8bar)
- zu Formaldehyd, Acetaldehyd, Methanol
Direktoxidation : - von Olefinen
- Ethylen zu Acetaldehyd
- 2CH2=CH2 + O2 2CH3 CHO
Reaktionen : Oxidation : - Aldehyde - unbeständig an der Luft - gehen stufenweise in Säuren über
- Bsp. : Acetaldehyd Essigsäure : 2CH3 CHO + O2 2CH3 COOH
Hydrierung : - zu primären Aldehyden - katalytisch
- Bsp. : Propionaldehyd Propanol : CH3 CH2 CHO + H2 C2H5 CH2OH
( Ni, Fe, Co, Edelmetallkat., 20-200°C, 300bar)
nucleophile Addition : - mit Alkoholen, Ammoniak, Wasser, Anionen
- über Halbacetale zu Acetalen :
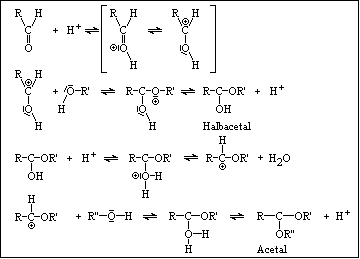
Mechanismus der nucleophilen Addition an Carbonylverbindungen
- Acetale - meist angenehmer Geruch
Polymerisation : niedrige Aldehyde zu thermisch stabilen Verbindungen (Polyoxymethylene,
Acetalkunststoffe)
allgemeine Reaktionen der aliphatischen Aldehyde :
Alkohole + H2 + NH3 Aldehyd-Ammoniak-Verbind.
Säuren, Säureanhydride + O2 + NH3, + H2 Amine
a - Halogenaldehyde + Halogene + NH3, -H2O Nitrile
Dihalogenpararffine + PCl5 + HCN Cyanhydride
Alkinole, -diole + C2H2 + HCN, + NH3 Aminosäuren
1, 3 - Dioxan + Olefine Aldehyd + R OH Acetale
Ester + Al (OR)3 + R SH Thiole
Hydroxyaldehyde + R CHO + H+ polymere Aldehyde
Polymethylolalkane + CH2O + R NH2 Azomethine
Hydroxyketone + Ketone + NH2 CO NH2 polymere Harnstoffe
Kohlenwasserstoffe + N2H4 + NaHSO3 Salze der a - Hydroxysulfonsäure
+ R Mg, + Halogene sekundäre Alkohole
wichtige Aldehyde :
Formaldehyd : - 1859 erstmals hergestellt von A. M. BUTLEROW
- HCHO - einfachster Aldehyd
- stechend riechend, farblos, leicht polymerisierendes Gas, löst sich in polaren Lösungsmitteln
unter Bildung von Solvaten, schleimhautreizend, brennbar
- MAK - Wert : 1 10-4% ; industrielle Abwässer - max. 200mg m-3 Formaldehyd
- wirkt krebserregend : - Reaktion mit Sekret der Nasenschleimhaut
- NH2 - Gruppen - nucleophil addiert an Carbonyl - C - Atom
- bei hohen Konzentrationen ( 7mg m-3 ) - dringt in Zelle / Zellkern vor
- reagieren mit Nucleinsäuren - führt zu Krebs
- gehört zu den chemisch aktivsten organischen Substanzen
- großmaßstäbliche Herstellung seit 1925 durch BASF aus Methanol
- 2CH3OH + O2 2HCHO + 2H2O DH = -159 KJ mol-1
- katalytische Oxydehydrierung mit geringer Luftmenge (Ag - Kat, 600-700°C, Wasserzusatz,
schnelle Abkühlung der Reaktionsprodukte, Ausbeute : 91%)
- katalytische Oxidation mit Luftüberschuß (Fe2O3/MoO3 - Kat., schnelle Abkühlung der
Reaktionsprodukte, 350-450°C, Ausbeute bis 99%)
- Methanoldampf mit Luft über erhitzten Kupfer - oder Silberkontakt
- heute - 92% aus Methanol, 8% aus Kohlenwasserstoffen
- Weltjahresproduktion ca. 8 mrd Tonnen
- Formen : - Hydrat (Formalin) : 35-55%-ige Lösung
- Trioxan - cyclische, trimere Form (Schmelzp. - 63°C, Siedep. - 115°C)
- Paraformaldehyd : - H (OCH2)n OH mit n = 10 - 100
- fest, kristallin
- entsteht, wenn Formaldehydlösung längere Zeit stehen bleibt :
- Selbstaddition aufgrund hoher Reaktivität
- 100 Moleküle - kettenförmig - Paraformaldehyd
- Verwendung : - direkt in wäßriger Lösung als Desinfektions - und Konservierungsmittel für verderbliche Güter wie Kosmetika (Formalin, Formol)
- Grundstoff für Herstellung mehrwertiger Alkohole
- Formaldehyd - Kondensationsprodukte mit Phenolen, Harnstoff und Melanin
- wichtige Aminoplaste, Duroplaste, Phenoplaste
- Trioxan - Grundstoff für hochpolymere thermoplastische Kunststoffe (Polyoxy-
methylene)
Acetaldehyd : - leichtbeweglich, niedrigsiedende, leicht entzündliche Flüssigkeit
(Ethanal) - stechender Geruch, ähnelt entfernt an unreife Apfel, ruft Kopfschmerz hervor
- giftig
- MAK - Wert - 0,02%
- mischt sich vollständig in Wasser und den meisten organische Lösungsmitteln
- reagiert mit Wasser zu Hydrat
- neigt zur Selbstaddition : - je 3 Moleküle zu cyclischem Paraldehyd
- je 4 Moleküle zu Metaldehyd
- bei Erhitzen - Zerfall in CH4 und CO
- Herstellung aus vielen Stoffen möglich z.B. Ethylen, Ethanol, Propan, Butan, Gährungsalkohol,
Methanol
- wichtig - WACKER - HOECHST - Verfahren [ ] : 2CH2=CH2 + O2 2CH3CHO
DH = -243 KJ mol-1
mit PdCl2/CuCl2 - Kat., 120-130°C, 3 bar, reines O2, anschließende zweistufige Destillation,
Ausbeute 94%
- Weltjahresproduktion ca. 3 mrd Tonnen ; BRD : 500.000 Tonnen pro Jahr
- größter Teil - Essigsäure - und Essigsäureanhydridherstellung, Butanol, 2 - Ethylhexanol,
Ethylacetat
- Zusatz für Aromastoffe (bei vollständiger Umsetzung)
Butylaldehyde : - C3H7CHO
- farblos, leicht entflammbar, stechend riechend, flüssig
- geringe Wasserlöslichkeit (ca. 2% bei 20°C)
- katalytische Hydrierung Butanol und 2 - Methyl - 1 - propanol
- Oxidation Carbonsäure
- Kondensations - und Additionsreaktionen mit sich selbst und mit anderen Aldehyden
Kunststoffe, Lösungsmittel, Lacken, Vulkanisationsbeschleunigern
- Herstellung : - Oxosynthese (kontinuierliche Hydroformylierung)
- Propen mit H2 und CO zu Gemisch beider Butylaldehyde (Butylaldehyd - 80%,
Isobutylaldehyd - 20%) mit DH = + (118-147) KJ mol-1
- Co - Kat, 148-180°C, 250-300bar, Ausbeute ca. 80%)
- außerdem - Nebenprodukte : Butanole, Butylformiate
- Weltjahresproduktion ca. 3 mrd Tonnen
Acrolein : - Acrylaldehyd, CH2=CH CHO
- einfachster ungesättigter Aldehyd
- leicht flüchtig, farblos, unerträglich stechend riechend, giftig, flüssig
- MAK - Wert - 0,1 mg cm-1
- in Wasser und den meisten organischen Lösungsmitteln löslich
- extrem reaktionsfreudig wird in der Nähe eines Stabilisators aufbewahrt (z.B. 0,2% Hydrochinon)
- Herstellung : - katalytische Oxidation von Propen (gasförmig)
- CH2=CH CH3 + O2 CH2=CH CHO + H2O DH = - 369 KJ mol-1
- Mo - Kat., 350-450°C, 1,5bar, Ausbeute ca. 90%
- Verwendung : - direkt als Warnsubstanz (Geruch)
- technisch in Glycerinherstellung und Methioninproduktion (Futtermittelzusatz)
Benzaldehyd : - C6H5 CHO
- einfachster aromatischer Aldehyd
- farblos, stark lichtbrechend, Bittermandelgeschmack, ungiftig, flüssig
- leicht löslich in Alkohol und Ether, kaum in Wasser (0,4% bei 25°C)
- oxidiert an der Luft zu Bezoesäure Aufbewahrung unter Stickstoff
- Herstellung : - Teiloxidation von Toluol
- Seitenkettenchlorierung mit anschließender Verseifung
- Verwendung : - direkt als Komponente von Geruchs - und Geschmacksstoffen (Bittermandelöl)
- Ausgangsstoff für Farbstoffe, Pharmazeutika, Riechstoffe, Nahrungsmittelzusatz
- EU - Jahresproduktion ca. 15000 Tonnen
Ketone :
Struktur : - eine oder mehrere Carbonylgruppen (C=O), deren C - Atom - Teil des Stammsystems ist und mit
zwei Kohlenwasserstoffresten verbunden ist
- Nomenklatur : - einfache lineare und cyclische Ketone - substitutiv - Vorsilbe Oxo oder
- Nachsilbe on
- Bsp. : 2 - Butanon : CH3 CH2 CO CH3
- Ausnahmen : Ketone mit Phenyl - oder Naphtylkomponenten - ophenon bzw.
onaphton
- Monoketone - keton Komponenten als Radikale - vorangestellt
- Bsp. : Ethylmethylketon : CH3 CO C2H5
- Unterscheidung in : - einfache (symmetrische) Ketone mit identischen Resten
- Bsp. : Diethylketon : C2H5 CO C2H5
- gemischte (unsymmetrische) Ketone mit verschieden Resten
- Bsp. : Methylpropylketon : CH3 CO C3H7
- mehrwertige Ketone mit mehreren Carbonylgruppen
- wichtige Ketone mit Trivialnamen :
- Aceton - CH3 CO CH3
- Acetonyl - CH3 CO CH2
- Acetonyliden - CH3 CO CH=
- Propiophenon - C6H5 CO C2H5
- Phenacyl - C6H5 CO CH2
- Phenacyliden - C6H5 CO CH=
- Desoxybenzoin - C6H5 CH2 CO C6H5
- Chalkon - C6H5 CH=CH CO C6H5
Eigenschaften : - meist leichtbeweglich, wasserklar, brennbar, flüssig (bei höheren Kettenlängen - fest)
- typischer Geruch
- löslich in den üblichen organischen Lösungsmitteln
- C - Gehalt Wasserlöslichkeit , Reaktionsfähigkeit
- aromatische Ketone - praktisch wasserunlöslich
- wegen Polarität der Carbonylgruppe - höhere Schmelz - und Siedepunkte als vergleichbare
unpolare Verbindungen
- Hydratbildung - nicht so ausgeprägt wie bei Aldehyden
- im Vergleich mit Aldehyden - schwer oxidierbar
- polymerisieren nicht
- narkotische Wirkung, ungiftig
- MAK - Werte : Aceton - 2,4 g m-3 ; Ethylmethylketon - 0,6g m-3
Reaktionen : - meist wie Aldehyde, aber geringer Reaktivität
- Oxidation zu Carbonsäuren : Aceton + Natriumhypochlorid Essigsäure
- Reduktion zu sekundären Alkoholen : Ethylmethylketon (+ Kat ) 2 - Butanol
CH3 CO C2H5 + H2 CH3 CHOH C2H5
- Halogenierung : Aceton + Brom zu Bromaceton
CH3 CO CH3 + Br2 CH3 CO CH2Br + HBr
Vorkommen : - in Natur als Champher (bicyclisches Keton) und als Bestandteil ätherischer Öle (vorwiegend
gesättigte, aliphatische Ketone)
Gewinnung : - katalytische Dehydrierung : sekundäre Alkohole zu aliphatischen Ketonen
R CHOH R' R' CO R + H2
- Acylierung : aromatische Ringe zu aromatischen Ketonen
C6H6 + Cl CO R C6H5 CO R + HCl
- Direktoxidation : Olefine zu Ketonen
- Nebenprodukte bei organischen Synthesen
Verwendung : - Lösungsmittel für Fette, Öle, Harze, Lacke (Aceton, 2 - Butanon, Methylisobutylketon)
- Zwischenprodukte für Farbstoffe, Insektizide, Herbizide
- höhere Ketone - Aromastoffe, hochsiedende Lösungsmittel, Stabilisatoren
wichtige Ketone
Aceton : - CH3 CO CH3
- einfachstes und technisch wichtigstes Keton
- angenehm (würzig) riechend, wasserhell, leichtbeweglich, brennbar, flüssig
- unbegrenzt in Wasser und den meisten organischen Lösungsmitteln löslich
- Herstellung : - natürliches Vorkommen in ätherischen Ölen und im Harn von Diabetikern (Acetonurie)
- als Nebenprodukt : Gärprozesse, Paraffinoxidation, Phenolherstellung
- WACKER - HOECHST - Verfahren : - katalytische Direktoxidation von Propen (flüssig
- 2CH3CH=CH2 + O2 2CH3 CO CH3
DH = - 255 KJ mol-1
- Zweistufenprozess, 110-120°C, 10-14bar, PdCl2-Kat.,
Ausbeute 92%
- Nebenprodukt - Propionaldehyd
- Isopropanol - Verfahren : - katalytische Dehydrierung von 2 - Propanol (gasförmig)
+ O2 2 CH3 CO CH3 + 2H2O DH = - 180 KJ mol-1
2(CH3)2CHOH
2 CH3 CO CH3 + H2 DH = + 67 KJ mol-1
- 300-400°C, 3bar, ZNO - Kat., Ausbeute 90%
- Weltjahresproduktion 2 mrd Tonnen 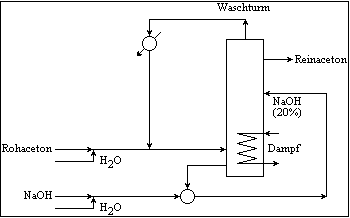
Acetonreinigung durch Waschen mit Natronlauge
- Verwendung : - 20-30% - Lösungsmittel für Harze, Lacke, Farben, Cellulose, Fette, Öle
- Rest - Einsatzmaterial für Zwischenprodukte wie Methylisobutylketon (MIBK),
Methylisoketonbutyl, Methacrylsäuremethylester
- Löslichkeitsvermittler zwischen z.B. Butanol und Wasser
2 - Butanon : - Methylethylketon - CH3 CO C2H5
- klar, leichtbeweglich, ungiftig, flüssig
- Geruch - acetonähnlich
- Dämpfe - narkotisierend
- mit Wasser - begrenzt löslich
- an Luft - explosive Peroxide
- Herstellung : Dehydrierung oder Oxidation von 2 - Butanol
- Verwendung : - Lösungsmittel für Kunststoffe, Natur - und Syntheseharze
- Herstellung von Kunstleder
- Extraktion von Fetten, Ölen, Wachsen
- Vergällungsmittel für Branntwein