|
Apoptoza
ca termen provine de la grecescul 'apoptosis', ce in traducere inseamna 'caderea
frunzelor'. Procesul sta la temelia unor fenomene de a parasi viata, cind celula si-a realizat functia. Celula se descompune foarte fin si in etape in componentele sale
moleculare, care ulterior vor fi utilizate de alte celule ale organismului.
Apoptoza nu numai ca participa in anumite etape ale dezvoltarii organismului
individual, dar si elimina celulele infectate de virusi, de altfel si celulele
ce devin focarul produselor toxice.
Modelul mortii celulelor - pe calea apoptozica sau a necrotica
- e dependenta si de concentratiile intracelulare de NAD+ si ATP. Micsorarea nivelului de NAD+ si ATP induce
necroza celulara (F.Oliver si al., 1999, P.Nicotera si al., 1997).
Intr-un organism
sanatos moartea programata celulara
(MPC) este un mecanism de mentinerea homeostaziei. Atat hipofunctia, at si hiperfunctia apoptozei are in
consecinta dereglari de homeostazie. Se considera actualmente, ca MPC este o etapa naturala de activitate a
celulelor animale.
Mecanismele
moleculare ale apoptozei.
Apoptoza
este un proces multifazic. Prima faza consta in primirea semnalului, aparitia
unei informatii, transmisa in celula din exteriorul ei sau generata in compartimentele ei. Semnalul este fixat de receptor
si supus analizei. Apoi semnalul este consecutiv transmis de mesagerii, de diferit rang, pana la nucleu, unde si are loc includerea programei
sinuciderii celulare prin activarea genelor letale sau represia celor antiletale. Realizarea MPC in sistemele nucleare, confirma ca prezenta nucleului nu este un component obligatoriu pentru efectuarea acestui proces.
Referitor la celulele animale si ale omului, apoptoza in majoritatea cazurilor este dependenta de activatia
proteolitica a cascadei de caspaze - o familie de proteaze cisteinice,
evolutiv conservative, care specific scindeaza proteinele dupa
resturile de acid aspartic. In corespundere cu omologia structurala caspazele
se deriva in subfamilii:
a) caspazele 1 (1 ),
b) caspazele 2 (2 si c) caspazele 3 (3, 6-10) (V.Kidd, 1999). E stabilit, ca apoptoza poate parcurge si fara aceste enzime: superproducerea
proteinelor- promotori ai apoptozei Bax si Bak induc MPC in prezenta
inhibitorilor caspazelor.
In rezultatul actiunii
caspazelor are loc:
☻activarea procaspazelor, cu formarea caspazelor;
☻scindarea proteinelor antiapoptozice din familia Bcl-2.
☻hidroliza proteinelor laminelor, ce stabilizeaza
membrana nucleara, cu condensarea cromatinei;
☻distrugerea proteinelor, participante la reglarea functiei
citoscheletului;
☻inactivarea si dereglarea reglarii proteinelor ce iau parte in
reperarea DNA, splaisigului mRNA, replicarii DNA. Tinta caspazelor este poli (ADP-ribozo) polimeraza (PARP). Aceasta enzima participa la repararea DNA, catalizand poli (ADP-ribozilare)
proteinele, legate de DNA.
(Новомилова A. si
al., 1996, Oliver F. si al., 1999).
Exista cateva cai de
realizare a MPC
(Новомилова A si
al. 1996, Raff M. 1998, Kumar S si al. 1999, Aravind L. si altii 1999):
1 Calea
determinata de inductorii fiziologici, actiunea carora se realizeaza prin recep-
torii celulari, ce au functia de a include mecanismele programei
apoptozei. Schematic ar putea fi in felul urmator: inductor > receptor > adaptori >
caspazele initiale > reglatori > caspazele finale. Receptorul (Fas) interactioneaza cu ligandul (FasL) (proteina transmem- branara
a T-Kiler), se activeaza si include
PMC infectata de virus (desen 1).
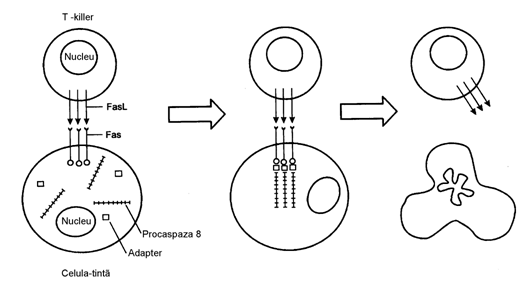
Desen 1. Apoptoza celulei tinta dependenta de Fas-receptor
sub actiunea T-limfocitelor (T-kiler)
Astfel, la
interactiunea cu FasL pe suprafata limfocitelor -T sau a anticorpului la
Fas-receptor mor beta-limfocitele, producatoare de anticorpi ce duc
Fas-receptor, care nu sunt necesare organismului insanatosit.
FasL - ligandul e componentul familiei factorilor necrotici ai
tumorilor (TNF) - o familie numeroasa de liganzi homotrimeri. Fas - prezinta
proteine transmembranare, care cu locusurile extracelulare interactioneaza cu trimerii liganzilor. Interactiunea receptor-ligand duce la formarea clasterelor
receptorici cu fixarea locusurilor intracelulare de adap- tori. Ultimii,
fixandu-se pe receptori, intra in actiune cu efectorii - cu caspazele
initiale, deocamdata neactive. Interactiunea descrisa se realizeaza prin
proteine omofile -interac- tiune proteica a domeniilor mici: DD (death domain
- domeniul mortii), DED (death efec- tor domain - domeniul efectorului
mortii), CARD (caspase activation and recruitment do- main - domeniul
activarii si recrutarii (inhibitiei) caspazei). Toate au structura
asemanatoa- re, contin sase alfa-catene. Mai bine e studiata procaspaza 8. Agregatul FasL - Fas -
FADD (Fas - associated DD-protein) - procaspaza 8 se activeaza, purtand
denumirea de apoptoso- ma (Green
D.S., 1998) sau semnal-complex, ce induce moartea (disc- death-inducing sig-
naling complex) (Peter H.si al, 1997)), sau ciaperonine apoptozice
(Hengartner M., 1998).
Procaspazele poseda
o activitate proteolitica joasa (1-2%) fiind in forma monomerica,
concentratia lor in celula e mica. Se considera ca apropierea spatiala la
agregarea lor duce la formarea caspazelor active prin auto- sau transscindare. In rezultat, de la procaspaza (masa moleculara
= 30-50 kDa) se detasaza domeniul N-reglator, iar restul moleculei diso-
ciaza in 2 subunitati: mare (20 kDa) si mica (aproximativ 10 kDa) (desen2).
In continuare are loc
asocierea lor in tetramer cu 2 centre catalitice independente, ce apare in
citozolul celulei. Sunt descrise si alte cai de activare a caspazei 8.
La faza activarii
caspazelor initiale viata celulei poate fi pastrata. Sunt descrisi regla-
torii, care blocheaza sau accelereaza efectul destructiv al caspazelor
initiale.
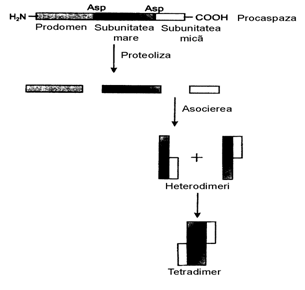
Desen 2. Activarea procaspazelor prin scindare
proteolitica in subunitati cu asocierea lor ulterioara.
Caspaza 8
activeaza caspaza finala (caspaza efector): prin proteoliza se genereaza caspaza 3, dupa ce procesul MPC devine
ireversibil (desen 3).
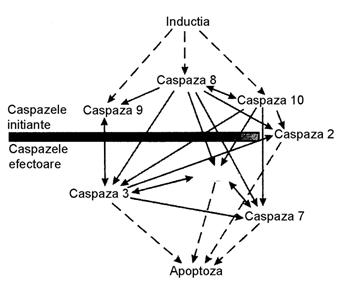
Desen 3. Interactiunea
functionala intre caspazele initiale si efectoare (finale) subfamiliei
caspazei 3.
Caspaza 2 are doua forme, una (ICH-IL) initiaza si alta (ICH-IS) inhiba apoptoza. Substratele intra- celulare nu sunt redate Caspaza 3 se poate
autoactiva, activand alte caspaze si DFF, ce duc la liza ireversibila a DNA
in fragmente nucleozomale.
2. In celulele, supuse actiunii inductorului apoptozei,
brusc se micsoreaza potentialul membranar, ce duce la majorarea permeabilitatii membranei interne mitocondriale, ca
consecinta la formarea porilor. (Bernardi P si al. 1998). Deschiderea porilor
e determinata de micsorarea cantitatii de glutation redus, NAD(P)H, ATP, ADP.
Recent se confirma ca un rol-cheie in apoptoza il poseda mitocondriile. Unul din simptomele
cele mai timpurii ale apoptozei e depolarizarea membranei interne mitocon-
condriale. Atit apoptoza, cit si depolarizarea membranei mitocondriale se
protejeaza prin utilizarea inhibitorilor, ce blocheaza formarea de pori in
membrana interna.
O analiza
minutioasa confirma prezenta unei legi fundamentale, ce are o arie de ras-
raspindire majora in lumea animala. Si, in final, se presupune, ca diferite
cauze pot provoca apoptoza, insa numai un singur mecanism permite celulei
sa-si realizeze ultimatumul mor- tal. Care-i cauza ca celula a ales anume
acest mecanism foarte compus de realizare a apop- tozei?
In 1994 s-a expus
ipoteza ca celula aeroba poseda un sistem esalonat de aparare la formarea
superoxidului - O.-2. Acest sistem functioneaza in ansamblu cu
mecanismele anti- oxidante, ce neutralizeaza superoxidul format sau produsele
transformarilor ulterioare.
In celulele fara DNA
mitocondrial (p°) apoptoza poate fi provocata de factorul necro- tic cancerigen (TNF), dar nu de antimicina A. In celulele martor (p+),
ce poseda mitocon- drii cu DNA, ambele substante induc apoptoza. Se
confirma ca natura semnalelor primare ce provoaca apoptoza e diferita. TNF e un semnal exterior de autodistrugere,
caruia celula se supune. Antimicina A este un inhibitor specific absolut, care blocheaza
transportul e- intre hemul bh si citocroma b .
Dintre proteinele
mitocondriale, ca factori apoptogeni sunt si: citocrom c, procaspazele 2, 3,
9; proteina AIF (apoptosis inducing factor), ce prezinta o flavoproteina cu
masa mole- culara de 57 kDa.
Citocrom c impreuna cu
factorul citoplasmatic APAF-1 (apoptosis protease activating factor -1) ia
parte la activarea caspazei 9. APAF -1 joaca rolul de schelet, unde are loc procesingul autocatalitic al caspazei 9. Modificarile conformationale, dependente de ATP duc la fixarea cit.C (desen 4), cu aparitia a noi conformatii. Oligomerizarea duce la deschiderea CAKD pentru procaspaza 9 cu domeniul identic. In final se formeaza o apoptosoma cu masa moleculara aproximativ 1,3 mln daltoni, ce contine minimum 8 subunitati APAF-1. Apropierea conformationala a moleculelor de procaspaze 9 pe fundamentul multimeric APAF-1-cit.C duce
la activarea caspazei 9. Caspaza 9 scindeaza si activeaza procaspaza 3. Flavoproteina AIF provoaca in celulele HeLa condensatia cromatinei si fragmentarea DNA, iar adaosul la mitocondriile ficatului de sobolan - eliberarea cit.C
si a caspazei 9. Efectele descrise nu sunt inhibate de inhibitorul caspazelor - L-VADfmk, care preintampina
apoptoza, indusa de cit.C. AIF - este un efector mitocondrial al MPC ce
activeaza indiferent de caspaze.
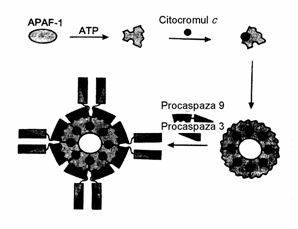
Desen 4. Model de formare a apoptosomei si activarea
procaspazei 9.
.
In unele cazuri MPC se realizeaza ca rezultat
al efectului combinat al 2 cai - cu par- ticiparea receptorilor membranei plasmatice si a citocromului C mitocondrial. Leza- rea DNA
duce la acumularea in celule a proteinelor genei p53, care stopeaza inmultirea celule- celulelor si
(sau) induce apoptoza. In mai mult de 50% cazuri in celulele cancerige- ne
gena p53 este inactiva - este dereglata reglarea homeostazei celulare de p53.
Aceasta proteina, p53,
este un factor de transcriptie, ce regleaza activitatea genelor. Se presupune
ca, raspunsul la formarea p53 e dependent de gradul de alterare a genomului celular.
Diferite cai ale apoptozei pot interactiona intre ele. In unele cazuri calea receptorica duce la activarea procaspazei 8
- putin efectiva. In asa caz se implica si calea mitocondriala a apoptozei - caspaza 8 interactioneaza cu proteina
citozolica Bid din familia Bax, sindan- d-o in 2 componente. Capatul
C-terminal al Bid se intercaleaza in membrana mitocondria-
la, inducand iesirea cit.C si fixarea lui de APAF-1.
. Exista si calea de transmitere a semnalului MPC cu participarea reticulului endo- plasmatic, unde-i localizata procaspaza 12. Dereglarile homeostaziei Ca2+ intracelular la
adaosul tapcigarginei sau a preparatului Ca2+ ionoforic - A23187 duc la apoptoza, determinata de activarea procaspazei 12.
Apoptoza, dependenta de RE este in maladia Alzheimer:
(neuronii corticali la soricei cu deficit de caspaza 12 sunt rezistenti la
apoptoza indusa de o proteina amiloidica, dar nu la apoptoza indusa de cit.c sau cu participarea receptorilor membranari).
Carnozina
este un dipeptid activ, b
-alanil-L-histidina, extras in 1900 din muschiul scheletal. Datele
experimentale confirm ca dipeptidul carnozina prezinta un antioxidant multifunctional, capabil sa inactiveze radicalii liberi,
sa formeze compusi helati cu metalele prooxidante (Cu) si poseda capacitate
de a forma conjugate cu produse aldehidice toxice de oxidare a lipidelor. Se
considera ca si peptidele inrudite iau parte in reglarea activitatii enzimatice, in diminuarea reactiilor oxidante.
Carnozina mareste longevitatea celulelor cultivate in vitro (de 2-3 ori).
Poseda efect de intinerire al celulelor.
Deosebirea cardinala
intre intre apoptoza si necroza, consta in faptul ca, pina la faza cea mai
matura morfologic deosebita - formarea compusilor apoptozei si fagocitoza lor
- membrana celulara isi pastreaza integritatea sa. Care va fi calea de moarte
celulara se hotaraste dupa analiza
multiplilor factori; unul din ei e si actiunea lezanta a formelor active de
oxigen. Un fenomen timpuriu in apoptoza sunt dereglarile oxidante intre
relatiile citoscheletului cu bistratul membranar, pentru care sunt
responsabile proteinele citoscheletului - aneksinele.
In rezultat creste mobilitatea fosfatidilserinei, care normal se gaseste in
stratul citozolic al membranei, insa dupa dereglarile relatiilor membrana -
schelet are loc difuzie de tipul "flip-flop" - si sunt gasite in partea
externa a bistratului.
Activarea prelungita a receptorilor glutamici, care are loc in dereglarile
functiei neuronilor, prezinta un factor ce provoaca moartea celulara. Un asa
proces e numit efect ekzatotoxic al
glutamatului. Asa mecanisme sunt determinante la imbatrinire, in caz de
afectiuni ca: parkinsonism, maladia Alzheimer
si in caz de dereglari acute in circulatia
cerebrala.
ROLUL SFINGOZINEI SI A PRODUSILOR EI IN REGLAREA MORTII CELULELOR
Studiile lui Hannum Y. si Bell P.
(1987) confirma capacitatea sfingozinei de a inhiba activitatea proteinkinazei
C - ferment cheie in reglarea proceselor proliferative si de diferentiere
a apoptozei. Autorii considera rolul sfingozinei drept un mesager secund.
Unele izoforme ale PKC sunt
foarte sensibile la actiunea ceramidei
si sfingomie-
linei si practic
aproape toate sunt inhibate de sfingozina si derivatii sai. Gradul de inhibi-
bitie a activitatii fermentative e dependent de relatiile cantitative intre
fosfatidilserina, Ca2+, diacilglicerina, eterul forbol,
lizofosfatidilcolina si acizii grasi. Analogul structural, stearilamina,
inhiba PKC ca si sfingozina, pe cind octilamina nu poseda efect asemanator.
Se confirma ca efectul e dependent nu numai de grupa NH2, dar si de marimea
lantului.
Azi se considera
argumentat ca sfingozina si sfingonina sunt inhibitorii endogeni
ai PKC. Majorarea sfingozinei in celule la influenta diferitor factori este
rezultatul scindarii ceramidei, dar nu a sintezei de novo. Eterul forbol, ca si acidul arahidonic, duce la majo- rarea
de 1,5 ori a nivelului ceramidei in celule.
Se confirma prezenta
PKC si in nucleul celulei, posibil o modificare a formei cito- plasmatice.
Prezenta sfingozinei in nucleu si modificarile concentratiei sale in
procesele legate de activarea nucleului celular presupun rolul nemijlocit ca
reglator negativ al enzi- mei localizate in structurile nucleice.
Sfingozina influenteaza si asupra
agregatiei trombocitelor, inhiba coagularea, are un efect anticancerigen si
antimicrobial, precum si capacitatea de a induce apoptoza.
Apoptoza, moartea
programata a celulei, sta la baza selectiei pozitive si negative a T si B-limfocitelor etc., joaca
un rol deosebit in apararea organismului de infectii virale. Imunodeficitul la
SID-infectie e determinata de dereglarile in controlul apoptozei.
Fosfolipidele sunt sursa de mesageri secunzi, ce iau parte la reglarea activitatii enzimelor apoptozei - a
proteinkinazelor, fosfatazelor, proteazelor. Interactiunea molecu- lelor
-semnale cu receptorul induc activatii in enzimele lipolitice (FLA2, C, D si sfingo- mielinazei) cu acumularea posterioara a rezultantelor
hidrolizei FL (ac.arahidonic, DAG, ceramidei), care nemijlocit participa la
transmiterea semnalelor induse. Dar numai produ- sele ciclului sfingomielinei (ceramida si sfingozina) poseda activitate
proapoptozica la contactul cu celula. S-a demonstrat ca acidul arahidonic,
AP, DAG, activeaza sfingomie- linaza si in final sunt capabili sa induca acumularea
in celula a produselor ciclului sfingo- mielinic.
Ca si sfingozina,
efect sinergic la actiunea comuna cu ceramida asupra celulei au si alti
inhibitori ai PKC. Ceramida este activator al fosfatazelor. Celulele
rezistente la apop- toza nu sunt capabile sa acumuleze ceramida si
sfingozina. Ceramida induce apoptoza in concentratii mai mari decit
sfingozina si se presupune ca actiunea stimulanta a lor e mai efectiva in
apoptoza la actiunea toxica asupra celulei. Sfingozina majoreaza efectul toxic
asupra celulei al diferitelor preparate antitumorale.
Fumonizina B, e un inhibitor al ceramidsintazei - enzima-cheie in
biosinteza lipide- lor de novo si
in transformarile sfingozinei in ceramida, inhiba cresterea celulelor si in-
duce moartea lor dupa tipul apoptozei. Ca rezultat al efectului FB, in celula
se acumulea- leaza sfinganina si sfingozina, care induc apoptoza. Sfingozina interactioneaza
activ cu DNA (enzimele replicatiei si transcriptiei). Ea implica formarea
mutatiilor de tipul modi- ficarilor scarii informative, aparute la efectul
antibioticului intercalar - carminomicinei.
Efectul dublu al
sfingozinei consta in urmatoarele: in
citosol regleaza enzimele care transmit semnalul apoptozei (fosfokinaze
si proteaze), in nucleu favorizeaza degradarea DNA,
interactionind cu ea.
In concentratii mici (pina la 10
mkM) sfingozina stimuleaza sinteza DNA, iar in concentratii mai mari, apare
moartea celulei. Este confirmat ca si compusii ei sunt foarte toxici pentru
toate celulele, inclusiv si pentru cele canceroase. In unele conditii au
efecte sinergiste in combinare cu alte preparate antitumorale.
Reglarea de catre
proteinele IAP
Activarea caspazelor si activitatea lor pot de
asemenea fi reglate de interactiunea cu proteine
inhibitorii ale apoptozei (IAP). Genele care codifica proteinele
virale IAP, la fel ca spectrul larg al
caspazei inhibitorii p35, au fost
clonate mai intai de la bacilo-virusuri bazandu-se pe abilitatea lor de a
inhiba virusurile inducand apoptoza in celulele lepidopterane. Desi celulele
mamiferelor nu par sa contina omologii lui p35, cel putin 5 omologi de la
mamifere ai proteinei bacilo-virale IAP au fost descrisi. Patru dintre aceste
polipeptide, cIAP-1, cIAP-2, XIAP si
NAIP, fiecare avand un domeniu N
terminal, continand multiple copii ale asa-numitului motiv repetitiv al
bacilo-virusului IAP (BIR), si un C terminal continand domeniu de
interactiune proteina- proteina (RING).
Al cincilea contine numai un domeniu BIR. La fel ca omologii virali, fiecare
din aceste polipeptide poate inhiba
apoptoza indusa de o varietate de stimuli. XIAP, cIAP-1, cIAP-2 dar nu si NAIP se leaga la o
caspaza inhibitorie activa 3 sau 7, de la o concentratie subnanomolara (XIAP)
la una submicromolara (cIAP-1 si cIAP-2). De asemenea, se leaga la o
procaspaza 9 si impiedica activarea ei. Pentru XIAP un singur domeniu BIR
pare sa fie responsabil de aceste efecte. Observatia ca cIAP-1 de asemenea se
leaga de TNFR-1 asociat polipeptidelor TRAF-1 si TRAF-2 in cursul interactiunii
cu motivele BIR cresc posibilitatea ca cIAPs, ca si IAPs-urile virale, pot
produce efecte aditionale inhiband moartea receptorilor care activeaza caspazele.
Expresia moleculelor IAP la mamifere variaza larg
printre diferitele tipuri de celule.Expresia supravietuirii, spre exemplu
este mai inalta intr-o varietate de
tumori decat in celulele normale. cIAP-1, cIAP-2 si XIAP au fost identificate
ca inductori NF-KB ai transcriptiei
care contribuie la protectia unor celule mediata de NF-KB fata de apoptoza
indusa de TNFα. Expresia acestor polipeptide in conditii aditionale
fiziologice si patologice necesita studii aprofundate.
|