Elemente de structura secundara
a proteinelor
Complexitatea proteinelor a facut necesara introducerea mai multor trepte de organizare structurala denumite structura primara, secundara, tertiara si structura cuaternara. Structura primara precizeaza numarul si secventa resturilor aminoacidice din molecula, ea reda totalitatea legaturilor covalente din molecula si mai este denumita si structura covalenta. Structura primara corespunde formulelor structurale uzuale ale unui compus organic. La moleculele simple astfel de formule definesc in acelasi timp si relatiile spatiale dintre atomi. La proteine cu lanturi lungi si un numar foarte mare de atomi sunt posibile numeroase conformatii (aranjamente spatiale rezultate prin rotatia libera a atomilor sau grupurilor de atomi in jurul legaturilor simple) si este necesara ierarhizarea nivelelor de organizare spatiala.
Structurile secundare rezultate din interactiunile grupelor C=O si NH din gruparile peptidice, sunt structuri ordonate, periodice, elementul structural care le genereaza prezinta el insusi regularitate. Structura tertiara a unui lant polipeptidic inglobeaza nivelul de organizare secundar la care se adauga modul de pliere, impachetare a lantului polipeptidic determinat de interactiunile posibile dintre radicalii R de la Cα , interactiunii ce depind atat de natura acestor radicali cat si de relatiile de vecinatate dintre ei. Descrierea organizarii spatiale a unui lant polipeptidic prin structura secundara si tertiala este arbitrara, cele douna nivele structurale se interpatrund, impreuna ele definesc conformatia specifica a lantului.
Proteinele alcatuite din mai multe lanturi polipeptidice (proteine oligomere) cuprin un nivel cuaternal de organizare. Structura cuaternara a unei proteine oligomere descrie modul in care lanturile polipeptidice individuale, se asociaza, se asambleaza pentru a realiza structura proteinei date.
Pauling si Colab, incepand cu anul 1930 au interprins studii sistematice, prin cristalografie cu raze X, de masurare a distantelor interatomice, o ungiurilor de legatura din aminoacizi, din peptide. S-a stabilit ca in gruparea peptidica are loc o conjugare -p, legatura ―NH―CO― capata un caracter partial de legatura dubla, rotatia libera in jurul acestei legaturi fiind astfel impiedicata. Atomii C vor adopta pozitii rigide fata de planul legaturii duble. In peptidele naturale se intalneste numai configuratia trans, mai stabila decat cea cis.
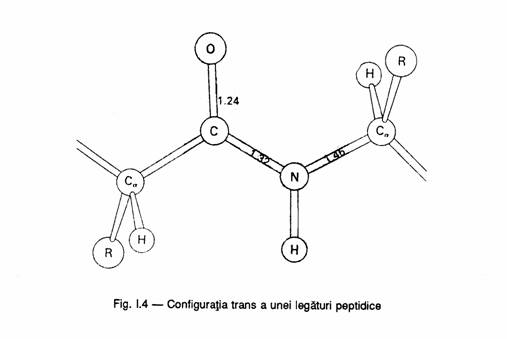
Configuratia trans a unei legaturi peptidice
Lantul peptidic isi pastreaza flexibilitatea prin rotatia libera in jurul legaturilor :
R1 si O R2
║ │
―CH― NH ― ―C― CH ―
O alta insusire o gruparii peptidice este capacitatea grupei NH de o forma o legatura de hidrogen cu un grup de C=O apartinand altei gropari peptidice :
N ― H --- O = C
Conjugarea π-p a gruparii peptidice accentueaza aceasta insusire.
Un lant peptidic, in solutie, ar putea adopta o infinitate de conformatii prin rotatii in jurul legaturilor ―CH(R1)― N si ―CH(R2)―CO . Unele din aceste conformatii vor fi mai stabile daca permit realizarea de punti de hidrogen intre gruparile peptidice. Plecand de la principiul ca aranjamentul cel mai stabil este acela in care se realizeaza cel mai mare nular de punti de hidrogen, Pauling si Corey (1951) au postulat 2 structuri secundare pentru lanuturile peptidice α - elicea si structura β. O structura elicoidala, distincta de cea descrisa de Pauling, este intalnita la colagen, proteina majora a matricei extracelulara, care are o compozitie aminoacida particulara.
STRUCTURA DE ELICE ALFA.Lantul polipeptidic se rasuceste( la nivelul legaturilor simple) pentru ca gruparile O=C si NH sa devina adiacente stereochimic pentru a forma punti de H. Se obtine astfel o structura repetitiva elicoidala in care toate unitatile se afla in raporturi spatiale identice cu unitatile vecine. O grupare NH formeaza punte de hidrogen cu gruparea CO apartinand celui de-al 4 lea rest aminoacidic din secventa liniara. In acest fel, toate gruparile CO si NH sunt unite prin punti de hidrogen.
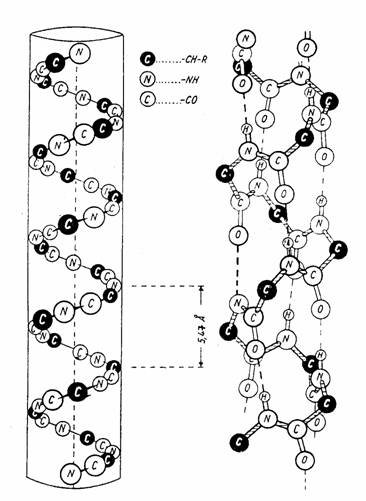
Structura secundara de α-elice a unui lant polipeptidic
Stereochimia gruparii peptidice, unghiurile de legatura, distantele interatomoce, coliniaritatea puntilor de hidrogen, apartenenta aminoacizilor la aceeasi serie optica (seria L) determina o anumita geometrie a α-elicei :
-cu fiecare rest aminoacidic se avanseaza pe verticala, cu 1,47 Å ;
-pasul elicei, distanta intre doua puncte echivalente pe verticala este de 5,21Å si cuprinde 3,6 resturi aminoacidice ;
-diametrul elicei, diametrul suprafetei cilindrice in care se afla atomii C , este de 10,1 Å;
-sensul rasucirii lantului polipeptidic este de la stanga la dreapta (elice dreapta) ;
-radicalii R ai tuturor aminoacizilor sunt orientati spre exteriorul elicei, configuratia atomilor C este aceeasi pentru toti aminoacizii;
-toate gruparile NH si C=O formeaza punti de hidrogen.
Un lant polipeptidic sub forma de α-eliceare forma unui bastonas cu diametrul de 10,1Å. Pentru 300 resturi aminoacidice lungimea acestui bastonas este de 450Å.
Structura α-elicoidala a lanturilor polipeptidice postulata de Pauling si Corey a fost gasita, in proportie mai mare sau mai mica, in diverse proteine.
|
Proteina |
% elice α |
|
Mioglobina Insulina Ovalbumina Serumalbumina Pepsina Ribonucleaza Chimotripsina |
|
Lungimea si repartizarea segmentelor de α-elice in cuprinsul moleculei este diferita de la o proteina la alta, in functie de distributia factorilor stabilizatori si destabilizatori ai elicei in structura primara. Resturile prolil, prin geometria lor particulara, impiedica rasucirea elicodala a lanturilor polipeptidice. La nivelul unui rest Pro, lantul se indoaie cu un unghi de 130ْ.
Resturile glicil, lipsite de catena laterala, confera lanturilor polipeptidice flexibilitate si adesea la nivelul resturilor Gly structura secundara α este intrerupta, lantul schimbandu-si usor directia.
Resturile de valina, izoleucina, treonina, prin radicalii voluminosi de la Cβ determina o stanjenire sterica daca aceste R ajung adiacente in elice. Serina, prin capacitatea de a forma punti de hidrogen prin gruparea alcoolica destabilizeaza elicea. Resturile de cisteina cand formeaza punti disulfurice leaga covalent, rigid, portiuni ale lantului polipeptidic si in vecinatatea acestor regiuni rasucirea elicoidala nu mai poate avea loc.
Stuctura secundara α se intalneste in diverse proportii atat la proteine fibrilare cat si la proteine globulare. O proteina fibrilara cu structura secundara α in proportie de aproape 100٪ este keratina, proteina abundenta in par, piele, unghii. Este alcatuita din lanturi polipeptidice lungi cu structura de α-elice ,asociate cate doua si superincolacite . Prin asocierea acestor dimeri se realizeaza fibrile si fibre rezistente . In aceste fibrile , gruparile R pot interactiona prin valente secundare in cele mai bune conditiuni . In plus, structura superelicoidala este stabilizata si prin punti disulfurice intercatenale , keratina avand un continut ridicat in cisteina .
Mioglobulina si hemoglobina au un procent mare (70٪) de structura secundara α .In aceste cazuri , segmentele de α-elice sunt scurte ,ele sunt intrerupte de portiuni neelicoidale .La nivelul acestora din urma, lantul polipeptidic isi schimba directia sub diverse unghiuri, permitand realizarea unei structuri compacte .
Un alt motiv structural intalnit la proteine cu un procent mare de structura secundara α contsa in asocierea paralela a unui numar de segmente de α-elice, aceste motiv structural putandu-se repeta de mai multe ori in cuprinsul moleculei proteice.
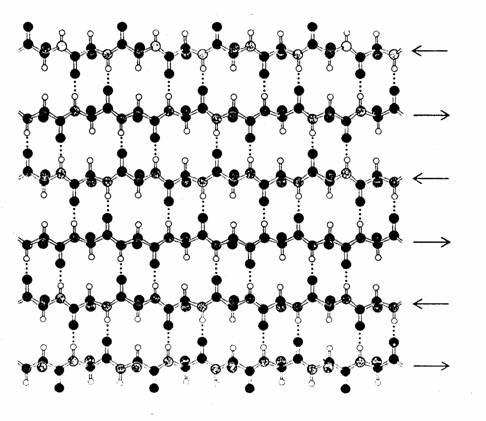
STRUCTURA β. O alta structura secundara a lanturilor polipeptidice in care se realizeaza potentialul maxim de legare prin punti de hidrogen a gruparilor C=O si NH este structura β sau structura in foaie plisata .In acest caz puntile de hidrogen sunt intercatenare , lanturile polipeptidice se aseaza in foi .Cea mai stabila interactiune se obtine daca lanturile evolueaza unul de la capatul N -terminal spre cel C-terminal si celalalt in sens invers.
Datorita rigiditatii legaturii peptidice si coplanaritatii grupului
│ │
― CH ― NH ― CO ― CH ― se realizeaza structuri asemanatoare unei foi plisate. Radicalii R mare sunt orientati, alternativ,de o parte si de alta.
Structura secundara β in foaie plisata este intalnita in proportie de aproape 100٪ in proteina din matase, fibroina. Lanturile polipeptidice antiparalele sunt intinse si asociate prin legaturi de hidrogen, dand nastere unei foi plisate. Aceste foi se aseaza in starturi, intre straturi se stabilesc numeroase legaturi intre gruparile R, care proemineaza de o parte si de alta a fiecarii foi. Datorita unei structuri primare speciale cu multe resturi Gly si Ala alternante, distantele dintre foi sunt mici (3,5Å si 5,7Å alternativ). Aceasta structura confera fibroinei rezistenta la intindere si flexibilitate.
Structurile β sunt motive structurale intalnite frecvent in proteine globulare. Cel mai simplu element de structura β consta intr-un lant polipeptidic indoit asupra lui insusi care realizeaza doua segmente antiparalele, denumit β-turn :
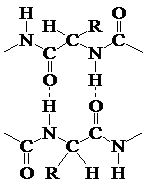
De asemenea, mai multe catene polipeptidice, de regula 6 dar si mai multe pot adopta structura β cu foi plisate. Domeniile structurale ale imunoglobulinelor si ale proteinelor de aceeasi superfamilie cuprind un motiv structural major β.
BIBLIOGRAFIE
Aurora Popescu, Veronica Dinu - « Mic tratat de biochimie Medicala », Editura Medicala, Bucuresti, 1996